1月13日,上海科技大学生命科学与技术学院仓勇课题组与上海交通大学医学院附属第九人民医院血液科主治医师路伟团队合作,在国际学术期刊《癌症研究》(Cancer Research)上发表了题为“Inhibition of mTOR Enhances the Efficacy of Proteasome-Dependent Targeted Protein Degradation Approaches”的研究论文,揭示了mTOR信号通路在调节蛋白酶体依赖性靶向蛋白降解(TPD)药物疗效中的关键作用,并提出了一种通过联合mTOR抑制剂来克服TPD药物耐药性的临床转化新策略。
靶向蛋白降解(Targeted Protein Degradation, TPD)技术是药物研发领域的一项突破性进展。与传统的占据驱动型抑制剂不同,TPD技术利用泛素-蛋白酶体系统(UPS)来清除传统上被认为“不可成药”的致病蛋白。目前,已有多种TPD药物在血液恶性肿瘤、乳腺癌等疾病的治疗中展现出临床潜力,如沙利度胺及其衍生物(来那度胺、泊马度胺)和ARV-471等。但随着治疗的延长,患者往往会产生耐药性,出现如E3连接酶表达下调或UPS组件突变等问题,严重限制了TPD疗法的长期疗效。因此,如何克服耐药性并提高TPD药物的疗效,是当前亟待解决的难题。
为了寻找能够增强TPD疗效的关键调节因子,本研究通过全基因组CRISPR筛选,鉴定出mTOR信号通路是决定TPD疗效的关键因素。mTOR通路在细胞代谢和生存中起核心作用,常在多种恶性肿瘤中异常激活。研究人员发现,mTOR通路的激活会削弱TPD的降解效率,而抑制mTOR信号则能显著增强包括分子胶和PROTACs在内的多种蛋白酶体依赖性降解剂的疗效。
机制上,mTOR抑制剂通过抑制蛋白质的从头合成(de novo protein synthesis),切断了目标蛋白的补充来源。当与TPD药物联用时,TPD药物负责降解现有的目标蛋白,而mTOR抑制剂则阻止新蛋白的生成,这种“双重打击”创造了一种协同效应,从而实现对靶蛋白更彻底、更快速的清除(图1)。

图1. 本研究作用机制示意图:mTOR抑制剂通过抑制蛋白合成,协同增强TPD药物对靶蛋白的清除效率
为了验证该策略的临床转化潜力,研究团队在多发性骨髓瘤(Multiple Myeloma, MM)模型中进行了相关测试。多发性骨髓瘤是一种浆细胞恶性增殖性疾病,免疫调节类药物(IMiDs,一类分子胶药物)是其治疗的基石。研究发现,在对IMiDs泊马度胺产生耐药的骨髓瘤细胞株中,加入mTOR抑制剂能够成功恢复细胞对药物的敏感性。更重要的是,在针对复发/难治性多发性骨髓瘤患者开展的mTOR抑制剂联合泊马度胺治疗的临床试验中,联合用药方案有效减少了患者体内恶性浆细胞的数量,显著改善多项临床指标。此外,该临床试验结果首次指出,mTOR抑制剂联合用药能够延缓骨髓瘤的耐药性产生,抑制疾病复发(图2)。
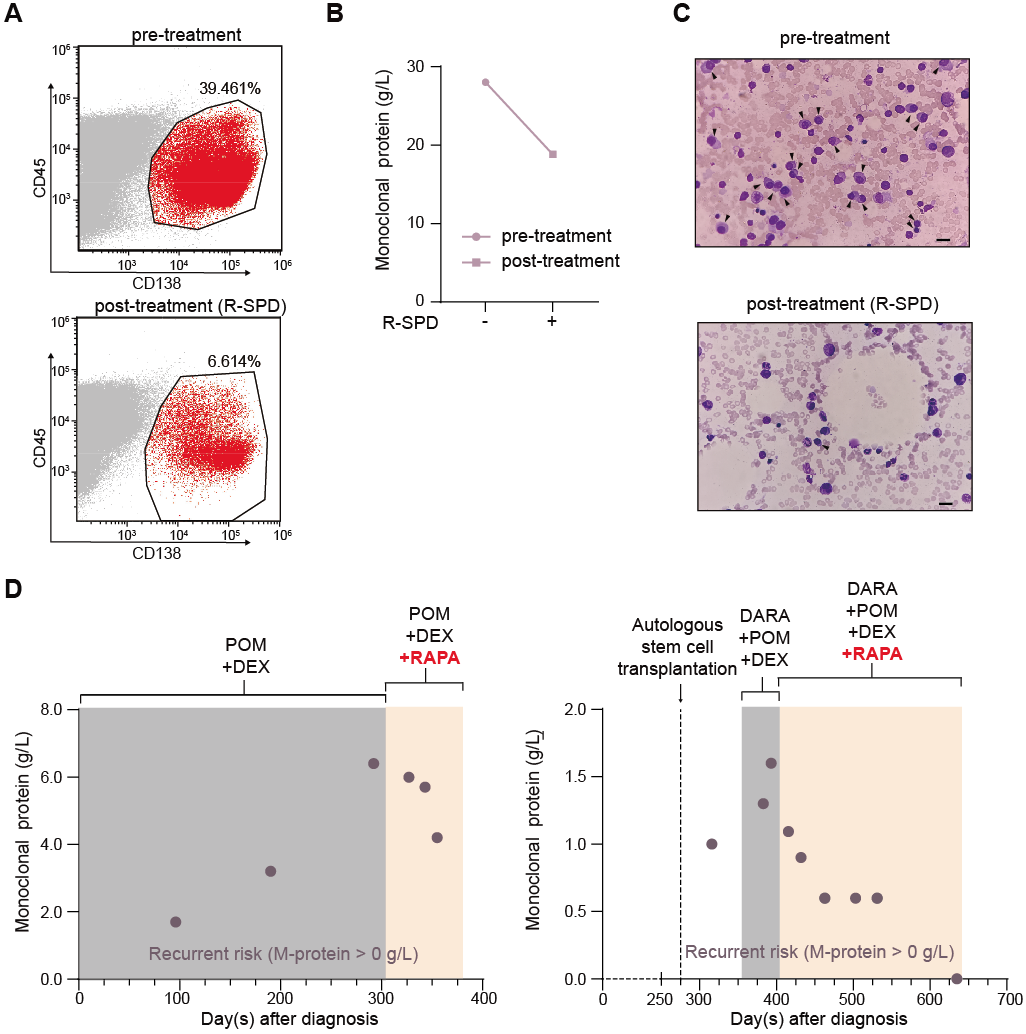
图2. mTOR抑制剂联合治疗改善复发/难治性多发性骨髓瘤患者的临床指标并延缓疾病复发
该研究表明,通过mTOR通路调控细胞内的蛋白稳态网络,可以显著提升TPD药物的治疗窗口。这不仅为理解TPD耐药机制提供了新视角,更为临床上通过联合已获批的mTOR抑制剂来增强分子胶或PROTACs疗效提供了直接的理论依据和治疗方案,具有极强的临床转化价值。
上海科技大学仓勇课题组2020级博士研究生刘旸、上海交通大学医学院附属第九人民医院血液科博士后孙漪峰、上海科技大学仓勇课题组博士后/Broad研究所宋天瑜为论文的共同第一作者。上海科技大学仓勇教授、上海交通大学医学院附属第九人民医院血液科主治医师路伟、上海科技大学仓勇课题组博士后/Broad研究所宋天瑜为该论文的共同通讯作者。上海科技大学为论文的第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号