近日,上海科技大学iHuman研究所徐菲团队联合比利时布鲁塞尔自由大学Steven Ballet团队,在国际知名学术期刊Protein & Cell发表了题为“Molecular Recognition at the Opioid-modulating Neuropeptide FF Receptor 1”的研究论文,利用冷冻电镜技术解析了神经肽FF受体1(NPFFR1)与两类内源性多肽配体NPFF、RFRP-3分别结合的Gi蛋白复合物高分辨率结构,阐明了配体识别、亚型选择性及受体激活的分子机制,为开发克服阿片类药物耐受和依赖的新型镇痛药物提供了关键结构基础。

阿片类药物是临床上治疗中重度疼痛的主要药物,但长期使用常导致耐受、依赖和戒断反应等严重副作用,滥用问题也已成为全球公共卫生危机。寻找既能增强镇痛效果、又能减少副作用的新型靶点,成为当前镇痛药物研发的重要方向。
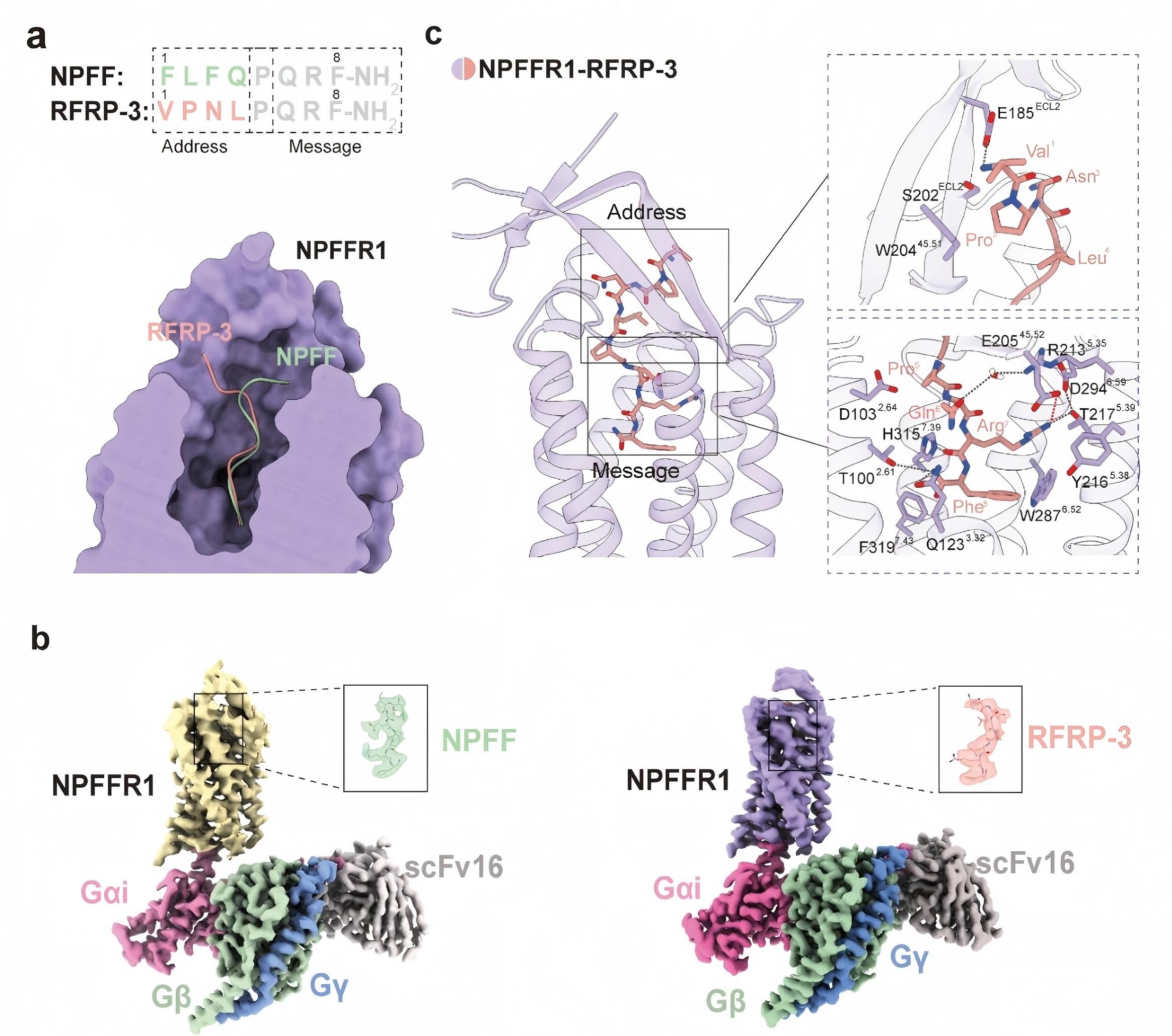
神经肽FF(NPFF)系统是调节阿片作用的重要通路,其家族包括NPFFR1和NPFFR2两个G蛋白偶联受体及多种内源性神经肽配体。研究发现,这两个受体在疼痛调控中具有相反作用:NPFFR1会削弱阿片镇痛并促进耐受,而NPFFR2则能增强镇痛、缓解耐受。选择性阻断NPFFR1可显著改善阿片类药物的镇痛效果并减少依赖,是极具潜力的镇痛药物靶点。然而,由于缺乏NPFFR1的高分辨率结构信息,其配体识别机制及与NPFFR2的差异性一直不清楚,限制了高选择性药物的设计。
该研究通过冷冻电镜解析获得了NPFF–NPFFR1–Gi和RFRP-3–NPFFR1–Gi两个复合物的高分辨率结构,并结合功能实验和分子动力学模拟,提出了类似阿片受体的“message–address”双段识别模式,揭示了RFRP-3配体高亲和力结合的结构基础以及NPFFR1与NPFFR2亚型选择性的关键残基。基于这些结构发现,研究团队提出了针对性的NPFFR1配体改造策略,如延长配体N端以增强与受体ECL2的特异性相互作用,或将N端缬氨酸替换为极性残基以形成氢键并避免与NPFFR2的空间冲突。这些策略为设计高选择性NPFFR1拮抗剂或激动剂提供了精确的分子模板。此类新型配体未来有望与阿片类药物联合使用,在增强镇痛效果的同时有效缓解耐受与依赖,为临床疼痛治疗带来新的突破。此外,该研究揭示的RF酰胺肽家族受体通用识别模式,也为其他相关G蛋白偶联受体的结构研究与药物研发提供了重要参考。
上海科技大学生命科学与技术学院2025届硕士研究生娜曼、iHuman研究所高级工程师岳洋为该论文的共同第一作者;岳洋和徐菲教授为共同通讯作者。上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号