近日,上海科技大学生命科学与技术学院王彤课题组在《欧洲分子生物学学会杂志》(The EMBO Journal)发表题为“Annexin A7 enhances TIA1 axonal trafficking to counteract pathological aggregation in neurons”的研究文章,报道了钙调蛋白 Annexin A7(ANXA7)介导无膜细胞器——核糖核蛋白颗粒(RNP)沿神经元轴突由末梢至胞体逆向运输的分子机制,可防止与渐冻人症相关的 TIA1 蛋白及其货物 mRNA 在轴突内异常聚集,从而避免由此引发的神经元退行性改变。本研究首次阐明了神经元轴突内RNP这一无膜细胞器的逆向运输机制,为神经退行性疾病的靶向治疗研究提供了新的思路。

在神经元中,mRNA常与RNA结合蛋白(RBP)形成无膜的RNP,作为轴突内RNA运输的基本单位,其稳定运输对于维持神经元稳态至关重要。然而,轴突运输受阻会导致RNP异常聚集并诱发神经退行性疾病,如肌萎缩侧索硬化症(ALS)和额颞叶痴呆(FTD)等。TIA1蛋白是一种能发生相分离的RNA结合蛋白,可形成应激颗粒;其家族性突变与神经元中的病理性蛋白聚集相关。但TIA1在轴突内的动态调控及其是否参与mRNA运输仍未知。
本研究通过活细胞成像发现,含有TIA1的RNP在神经元轴突中主要以由末梢至胞体的逆向方式运动(视频1),并依赖细胞质动力蛋白(dynein)实现运输。质谱分析结合多种细胞与生化实验进一步表明,ANXA7可作为连接TIA1与动力蛋白dynein的关键“分子桥梁”,介导TIA1-RNP的轴突逆向运输。
视频1. TIA1 核糖核蛋白颗粒的轴突逆向运输
此外,研究还发现ANXA7介导的运输过程受到神经元内钙离子(Ca²⁺)水平的精细调控。钙超载会诱导ANXA7-TIA1 复合物发生相分离,阻断其轴突运输,导致TIA1颗粒在轴突内滞留并形成异常聚集。细胞实验和动物模型进一步表明,敲低 ANXA7会引起从皮层到脊髓长距离投射的运动神经元发生退行性病变,并导致小鼠出现运动功能障碍;而过表达ANXA7可有效挽救TIA1颗粒的运输缺陷并逆转相关病理表型。这表明ANXA7通过介导TIA1颗粒的逆向轴突运输,防止其发生病理性蛋白聚集。该机制在维持神经元轴突稳态方面发挥关键性的保护作用(图1)。
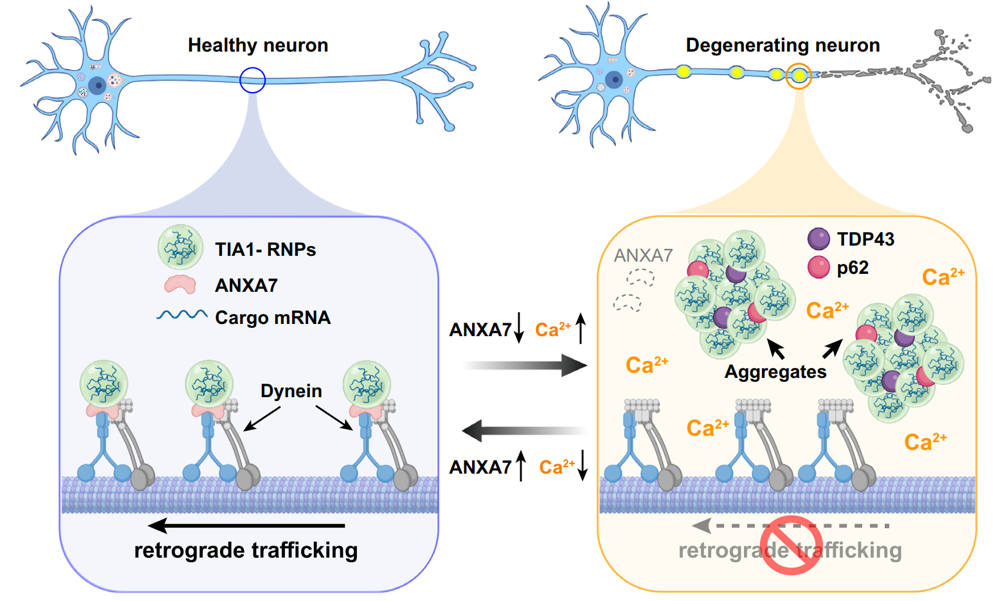
图1. ANXA7 介导 TIA1 颗粒在神经元轴突中逆向运输的机理
本研究首次系统揭示了一种钙依赖的RNP在神经元轴突中的逆向运输机制,并阐明了维持神经元内相分离蛋白动态平衡的关键调控环节。该发现不仅深化了对神经元轴突内RNP运输机制的理解,也为干预蛋白异常聚集相关的神经退行性疾病提供了新的潜在靶点。
上海科技大学生命科学与技术学院王彤课题组2021级博士研究生冯妤和2024级博士研究生栾童舒为论文共同第一作者,王彤教授为通讯作者。上海科技大学为论文的唯一完成单位和通讯单位。
文章链接:https://www.embopress.org/doi/full/10.1038/s44318-025-00609-8


 沪公网安备 31011502006855号
沪公网安备 31011502006855号