近日,上海科技大学iHuman研究所徐菲课题组在《细胞研究》(Cell Research)上发表题为“Constitutive arrestin recruitment by orphan GPR52 via an atypical binding mode”的研究成果,解析了孤儿受体GPR52与下游信号转导蛋白β-arrestin1的复合物结构并揭示了一种独特的结合模式。该工作不仅深化了对GPR52组成性活性的分子机制理解,也为系统认知孤儿受体的信号转导网络提供了关键结构基础。

徐菲团队长期致力于孤儿受体的结构与功能研究,先后解析了多种孤儿受体的结构并阐明了该类受体独特的激活机制,包括GPCR中A家族的GPR52、GPR21、GPR20,以及C家族的GPRC5D,相关成果分别发表于Nature(2020),Nature Communications(2023, 2024)以及Cell Discovery(2023)等国际期刊。
孤儿受体GPR52主要表达于大脑纹状体,与精神分裂症、多动症、精神疾病以及亨廷顿病等多种神经系统疾病密切相关,已有一款小分子进入临床I期用于治疗精神分裂症。GPR52因此被视为极具潜力的治疗靶点,是当前备受关注的孤儿受体之一。GPR52在缺乏配体激动剂的情况下仍表现出高水平的基础活性,即组成性活性。研究团队此前解析了无配体状态下的GPR52–Gs蛋白复合物结构,阐明了其在G蛋白信号通路中的自激活机制。然而,GPR52如何与arrestin等其他信号转导蛋白相互作用仍然未知,限制了对其组成性激活机制与偏向性机制的整体理解。
本研究通过对现有功能实验的优化与改造,首次发现GPR52对arrestin招募同样具有组成活性。通过冷冻电镜结构研究发现,与在G蛋白组成激活中的“内置激动剂”作用类似,GPR52结构中的第二个胞外环(ECL2)在arrestin信号通路中也具有关键作用。此外还发现arrestin并未按照经典模式结合受体胞内的核心区域,而是侧向攀附——主要锚定在胞内的ICL1与H8位点,受体整体仍保持“非活化”构象,且该构象与有无结合配体无关。该发现首次为孤儿GPCR与arrestin的相互作用提供了结构蓝本,也为设计G蛋白偏向或arrestin偏向的GPR52小分子药物提供了结构基础,为理解GPR52乃至更广泛的孤儿受体如何介导G蛋白与arrestin通路之间的内在信号调控提供了新的视角。
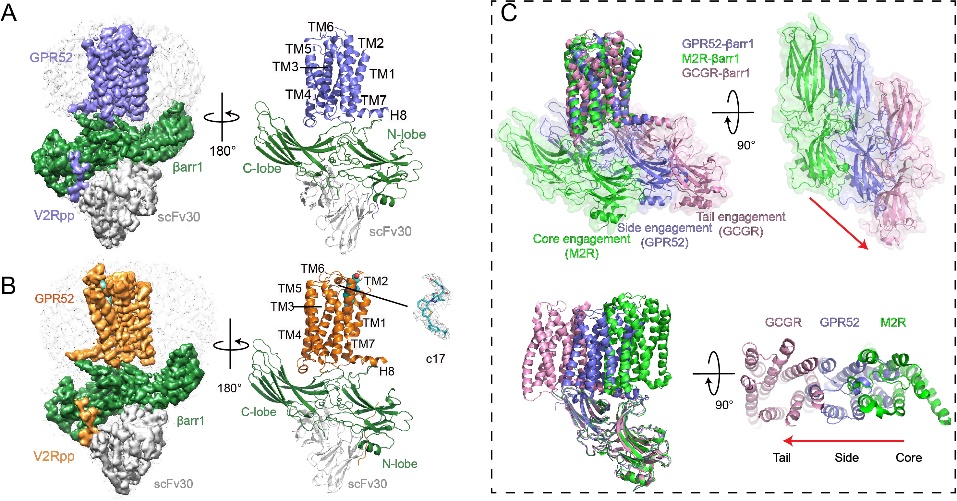
图1:(A和B)无配体(A)或c17(B)结合的GPR52-arrestin复合物的结构。(C)GPR52通过一种非典型组装模式结合β-arrestin1。
上海科技大学iHuman研究所副研究员林浠、生命科学与技术学院2021届博士研究生未小虎和2023级研究生蒲宁为该论文的共同第一作者;林浠和iHuman研究所研究员、生命科学与技术学院常任教授徐菲为共同通讯作者。上海科技大学为唯一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号