近日,上海科技大学免疫化学研究所杨光教授团队联合同济大学梁爱斌教授、牛津大学Raymond A. Dwek与Nicole Zitzmann教授组成的跨国科研团队,在《自然-通讯》(Nature Communications)发表了题为“A broadly neutralizing antibody recognizes a unique epitope with a signature motif common across coronaviruses”的研究论文,成功鉴定出一种靶向冠状病毒保守表位的广谱中和抗体,实现了从“特异性”到“广谱性”的突破,为应对未来冠状病毒跨物种传播提供了潜在干预策略。
研究团队针对SARS-CoV-2刺突蛋白中高度保守的HR1结构域(该区域在病毒膜融合过程中短暂暴露),通过筛选新冠大流行前构建的全人源抗体库,成功鉴定出单克隆抗体3D1。该抗体能特异性识别HR1结构域中一个高度保守的六氨基酸核心表位(DVVNQN/Q)。高分辨率X射线晶体学分析显示,3D1通过结合HR1中独特的I型β转角(β-turn)构象介导中和活性(图1)。
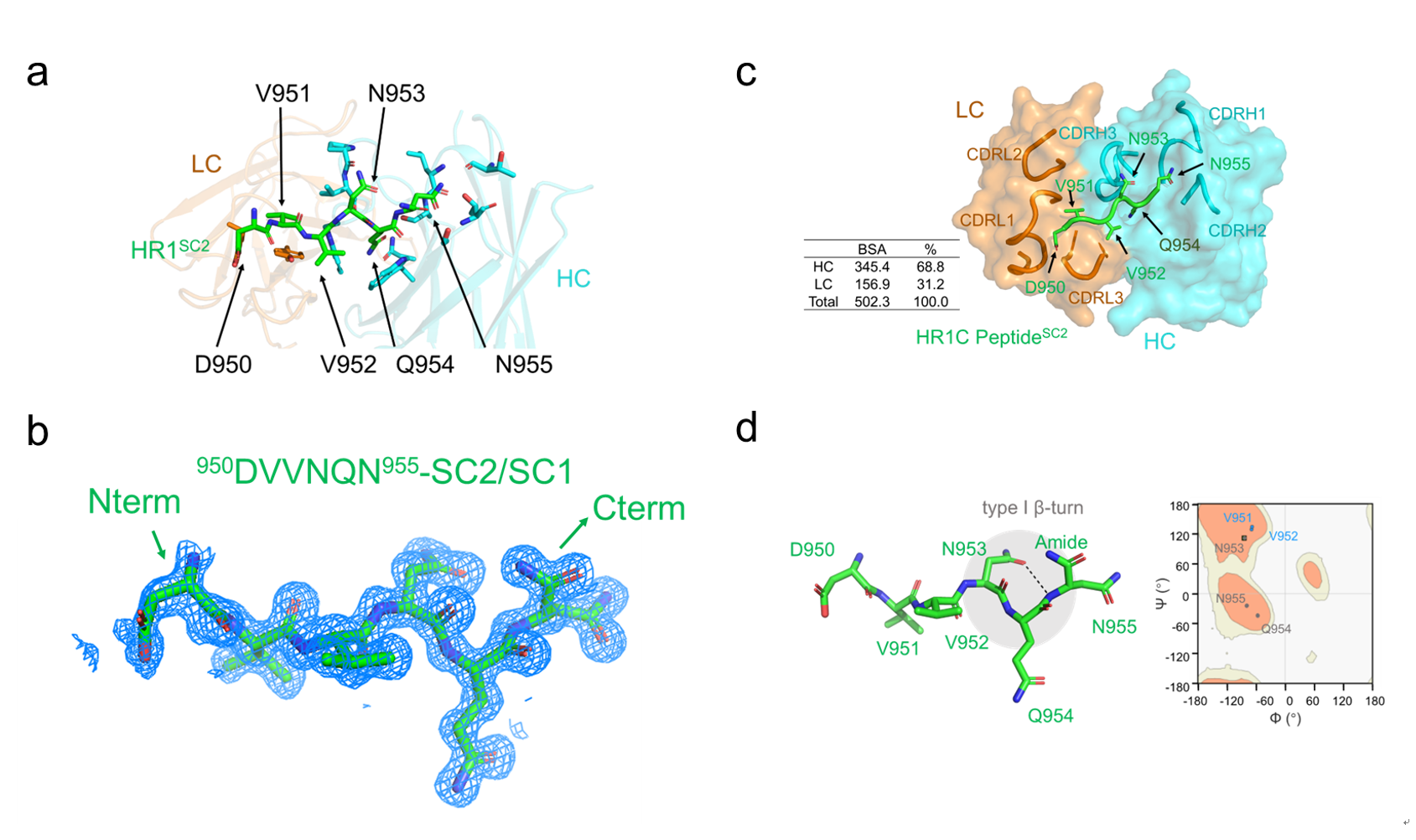
图1a. 3D1-肽段复合物整体结构;图1b. 肽段电子密度图;图1c. 重轻链界面互作;图1d. β转角结构特征
进一步机制研究表明,该表位仅在病毒侵染宿主细胞的膜融合前预发夹过渡态中短暂暴露,这一特性揭示了3D1抗体的高亲和力与独特识别模式(图2)。通过RNA病毒序列比对和生物化学实验验证,研究人员发现该表位不仅在冠状病毒所有属(α/β/γ/δ)中高度保守,还存在于HIV和马尔堡病毒中,这使抗体3D1具有广谱中和多种RNA病毒的能力。活病毒实验证实,3D1能有效抑制新冠病毒,且对除Omicron外的所有免疫逃逸突变株均保持中和活性。

图2a. 刺突蛋白-hACE2介导的细胞膜融合实验;图2b. 3D1对SARS-CoV-2六螺旋束(6-HB)构象的剂量依赖性抑制;图2c. 3D1结合态HR1构象与不同融合态构象对比;图2d. 病毒刺突蛋白介导的膜融合示意图。
抗体序列溯源分析显示,3D1的编码基因源自罕见的IGHV7种系基因(在部分人群中为假基因)。研究发现,该抗体在种系状态下(未经体细胞高频突变)即表现出对HR1结构域的超强结合能力,提示HR1作为一种保守的原始结构模体(七次重复序列),可能在病毒进化过程中被保留并作为关键功能域。系统解析抗体-病毒相互作用界面并绘制关键保守表位图谱,将显著提升对冠状病毒及其他病毒变异的预警能力,为开发针对性干预策略提供分子基础。
上海科技大学免疫化学研究所杨光课题组博士后严磊为本文第一作者,上海科技大学特聘教授杨光与同济大学附属同济医院梁爱斌教授为共同通讯作者。上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号