近日,上海科技大学生命科学与技术学院许文青团队在《蛋白质与细胞》(Protein & Cell)杂志发表了题为“Structure-based engineering of the midnolin-proteasome pathway for targeted protein degradation”的研究文章,解析了midnolin-蛋白酶体复合物的冷冻电镜结构,并开发了全球首个基于midnolin的靶向蛋白质降解平台——MidTAC,为治疗“不可成药”靶点相关疾病(如癌症)带来了全新的希望。
在细胞中,蛋白质的“寿命”通常由泛素-蛋白酶体途径决定——这曾经被认为是蛋白质降解的“黄金准则”。然而,近期发现Midnolin-蛋白酶体途径以非泛素化依赖的方式,可直接招募底物进行降解,它可能代表了蛋白酶体绕过泛素化系统实现蛋白选择性降解的普遍机制。Midnolin作为调控蛋白质稳态的关键因子,介导细胞核内底物如即刻早期基因编码蛋白及其他细胞类型特异性转录调节因子的精准快速降解,响应细胞内应激与代谢信号的动态变化。
研究团队运用冷冻电镜技术解析了midnolin-蛋白酶体复合物的高分辨率三维结构,揭示了midnolin与蛋白酶体结合并介导底物降解的三种不同构象(图1)。结果表明midnolin的C端α螺旋(C-Helix)紧固锚定在蛋白酶体RPN1亚基上,而其N端泛素样结构域(UBL)则与蛋白酶体RPN11亚基发生相互作用,形成独特的双臂蛋白酶体结合模式,高效降解蛋白质。在该结合模式下,招募底物的midnolin Catch结构域在空间上精确定位于蛋白酶体AAA-ATP酶马达上方,方便底物去折叠及降解。该研究成功捕捉了midnolin从C-Helix锚定、UBL识别到底物加工的动态构象变化过程,为阐明midnolin直接招募底物至蛋白酶体降解的分子机制提供了关键结构证据。
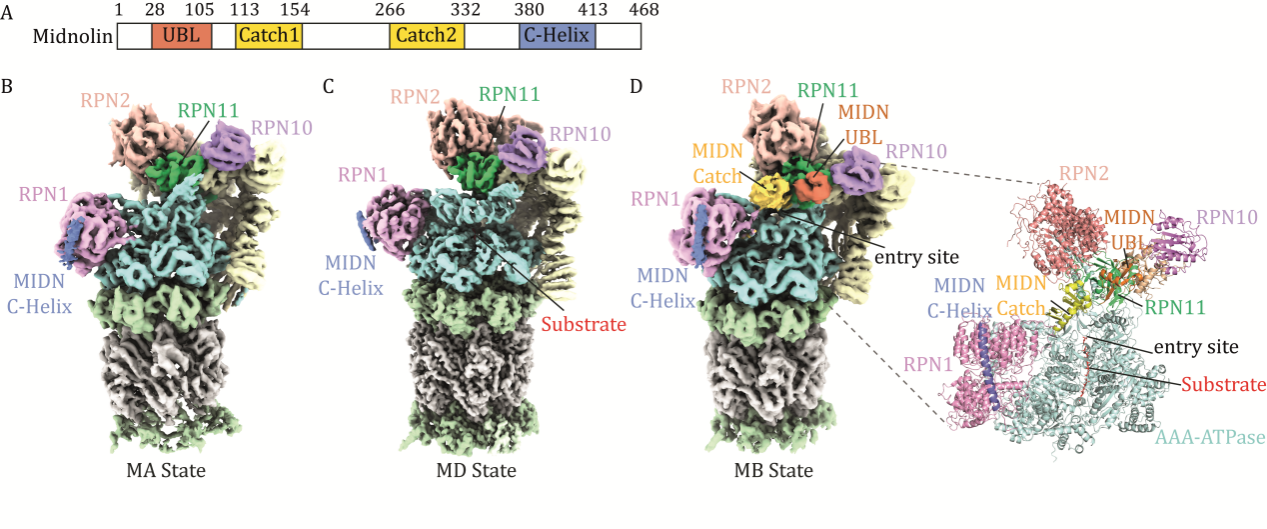
图1 Midnolin-蛋白酶体复合物的冷冻电镜结构
基于对midnolin-26S蛋白酶体途径降解蛋白分子机制的深入理解,研究团队开发了名为MidTAC(Midnolin-based Targeting Chimera)的靶向蛋白质降解(TPD)技术(图2)。MidTAC技术将midnolin的Catch结构域替换为特定靶蛋白的结合结构域或基序,可特异性引导靶蛋白至蛋白酶体进行降解。令人振奋的是,MidTAC在HEK293T细胞内成功实现了对细胞核内β-catenin的特异性降解,且不影响细胞质中参与细胞黏附功能的 β-catenin含量。这一特性对于治疗由Wnt信号通路异常激活所驱动的癌症(如结直肠癌)具有重要意义。因此,MidTAC展现出了高度的蛋白靶向特异性,为开发针对“不可成药”靶点的新型治疗策略提供了重要工具,具有广阔的临床转化潜力。
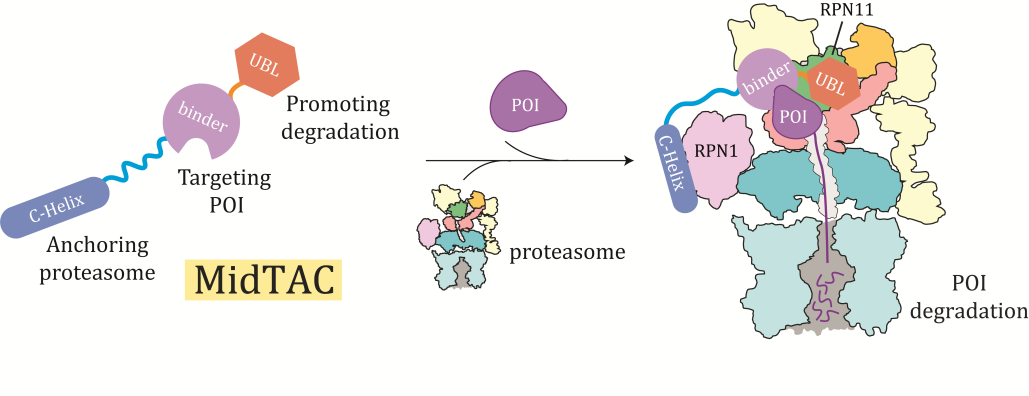
图2 MidTAC靶向蛋白降解技术的工作示意图
基于传统的泛素-蛋白酶体途径的TPD技术,如PROTAC和分子胶,已然革新了药物研发领域。由于可用E3的匮乏和泛素化及去泛素化过程的复杂性,这些依赖泛素化的方法在具体治疗应用中仍然面临诸多挑战。本工作基于Midnolin-蛋白酶体这一非泛素化蛋白降解途径研发的MidTAC技术或将成为解决该领域关键挑战的方案之一。MidTAC技术具有诸多优势,它可靶向那些缺乏泛素化位点的蛋白、攻克传统E3连接酶无法识别的“不可成药”靶点,更可实现亚细胞定位特异性的蛋白降解,以提升治疗精准性,从而开发出更安全、更高效的新型抗肿瘤药物。
上海科技大学许文青教授和王红杨副研究员为该研究论文的通讯作者,王红杨博士为本文的第一作者。上海中医药大学柯细松课题组、上海科技大学张璐课题组和王权课题组为该研究提供了重要支持和帮助。
论文链接:https://academic.oup.com/proteincell/advance-article/doi/10.1093/procel/pwaf069/8240538?login=true


 沪公网安备 31011502006855号
沪公网安备 31011502006855号