近日,上海科技大学iHuman 研究所徐菲课题组与华中科技大学刘剑峰团队再度合作,在《自然-通讯》(Nature Communications)发表题为“Mechanistic Insights into the Versatile Stoichiometry and Biased Signaling of the Apelin Receptor-Arrestin Complex” 的研究论文,首次解析了爱帕琳肽受体(apelin receptor, APJR)与信号转导蛋白 β-arrestin1 形成二聚体复合物的冷冻电镜结构,揭示了 APJR 通过动态调控与 β-arrestin 的化学计量比以及相互作用从而实现偏向性信号传导的分子机制,为肥胖、心血管及衰老等疾病的创新药物研发提供了关键结构基础和理论依据。

徐菲团队长期深耕APJR研究领域:2017 年率先解析首个APJR晶体结构,2022年首次揭示APJR与下游Gi蛋白复合物的单体/二聚体结构,为理解其信号激活机制奠定了重要基础。2025年初揭示了G蛋白偶联可能在APJR激活过程中起到促进二聚体解离的作用。然而,APJR与β-arrestin的相互作用机制一直缺乏直接结构证据,制约了对其“双信号通路”(Gi蛋白通路与β-arrestin通路)调控的深入理解。其中,Gi通路激活具有心脏保护作用,而β-arrestin通路过度激活可能导致心肌肥厚等副作用。因此,解析APJR-β-arrestin复合物结构成为破解其偏向性信号机制进而指导开发偏向性激动剂药物的关键。
研究团队利用单颗粒冷冻电镜技术,成功解析了三种APJR-β-arrestin1 复合物的高分辨率结构(图1)。这些结构首次揭示,与其他A类GPCR多以1:1比例结合β-arrestin不同,APJR可通过灵活的二聚体形式与β-arrestin形成2:2或2:1复合物,展现出独特的“动态结合”特征。功能研究发现,2:2结构是实现β-arrestin最大招募效率的关键,而2:1结构则可能反映了信号激活过程中的中间状态。进一步分析发现,APJR上的关键残基(如R1273.50)和L3.43Y5.58L6.40疏水网络在调控β-arrestin结合中发挥决定性作用,为设计“Gi 偏向性激动剂”提供了新的思路(图2)。
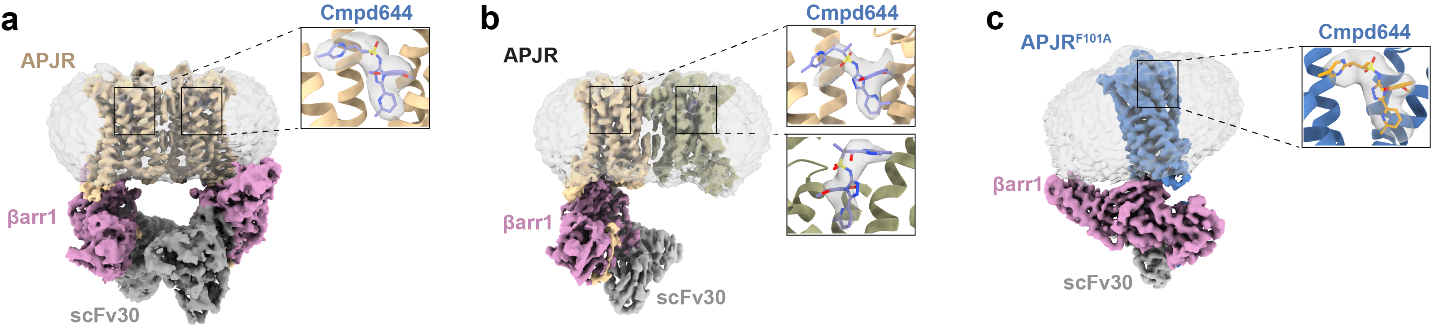
图1:APJR-β-arrestin1复合物结合cmpd644(临床阶段药物的类似物Azelaprag)的冷冻电镜结构。(a)APJR与β-arrestin1结合的2:2化学计量比结构。(b)APJR与 β-arrestin1结合的2:1化学计量比结构。(c)单体突变型APJR(F101A)与β-arrestin1结合的1:1化学计量比结构。
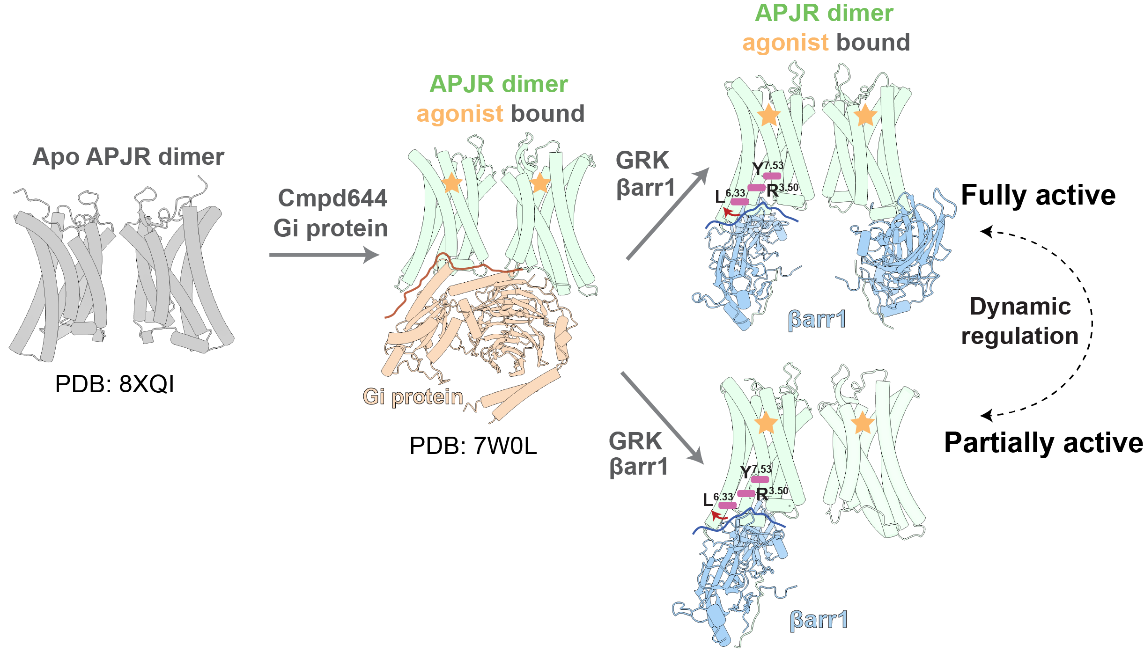
图2:APJR二聚体与Gi蛋白或β-arrestin结合时的结构动态模型。APJR二聚体的激活:APJR二聚体的apo形式(灰色)在结合激动剂cmpd644并与Gi蛋白(橙色)结合后,转变为完全激活状态,形成2:1的APJR-Gi蛋白复合物。另一方面,APJR二聚体(绿色)可与βarr1(蓝色)结合,分别形成2:2和2:1化学计量比的完全激活和部分激活的APJR-βarr1复合物。红色箭头指示了在与βarr1结合的状态下跨膜区6(TM6)的进一步运动,重点标注了关键残基R3.50、L6.33和Y7.53。
该研究不仅填补了APJR-β-arrestin相互作用的结构空白,更建立了“化学计量比-构象变化-信号输出”的关联模型,为理解GPCR多聚化调控机制以及偏向性信号传导提供了全新框架。同时,也为优化针对心力衰竭、肥胖及衰老相关疾病等药物的信号偏向性、提升治疗窗口提供了直接结构依据,有望加速针对APJR的下一代精准治疗药物研发。
上海科技大学iHuman研究所高级工程师岳洋、副研究员武丽杰,以及华中科技大学副研究员许婵娟为该论文共同第一作者;华中科技大学刘剑峰教授和上海科技大学iHuman研究所、生命学院常任正教授徐菲为共同通讯作者。上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号