CRISPR-Cas基因编辑技术凭借其高效性和便捷性,已在生物医药、农业育种及合成生物学领域得到广泛应用。然而,主流核酸酶Cas9和Cas12a因分子量过大(超过1000个氨基酸)而难以高效在体递送,限制了其临床应用。2023年,上海科技大学物质科学与技术学院季泉江团队发现了一类全新的超小型CRISPR-Cas12n系统(400-700个氨基酸),不仅能识别罕见的A富集PAM序列,还在细菌和人类细胞中展现出高效编辑能力。团队表征了四种同源核酸酶(AcCas12n、RdCas12n、MlCas12n和CgCas12n),其中天然AcCas12n具备高编辑活性,经过工程优化后的Cas12Pro在大多数基因组位点的编辑效率已达到常规Cas9/Cas12a水平。
为深入理解这一系统的工作原理,季泉江团队成功解析了RdCas12n与sgRNA及目标DNA形成的三元复合体结构,首次揭示其分子作用机制,研究成果以“Mechanisms and engineering of a miniature type V-N CRISPR-Cas12 effector enzyme”为题发表于《自然-通讯》(Nature Communications)。研究发现,RdCas12n以单体形式发挥作用,区别于另一类常用的通过核酸酶二聚化发挥功能的超小型基因编辑系统CRISPR-Cas12f(图1)。
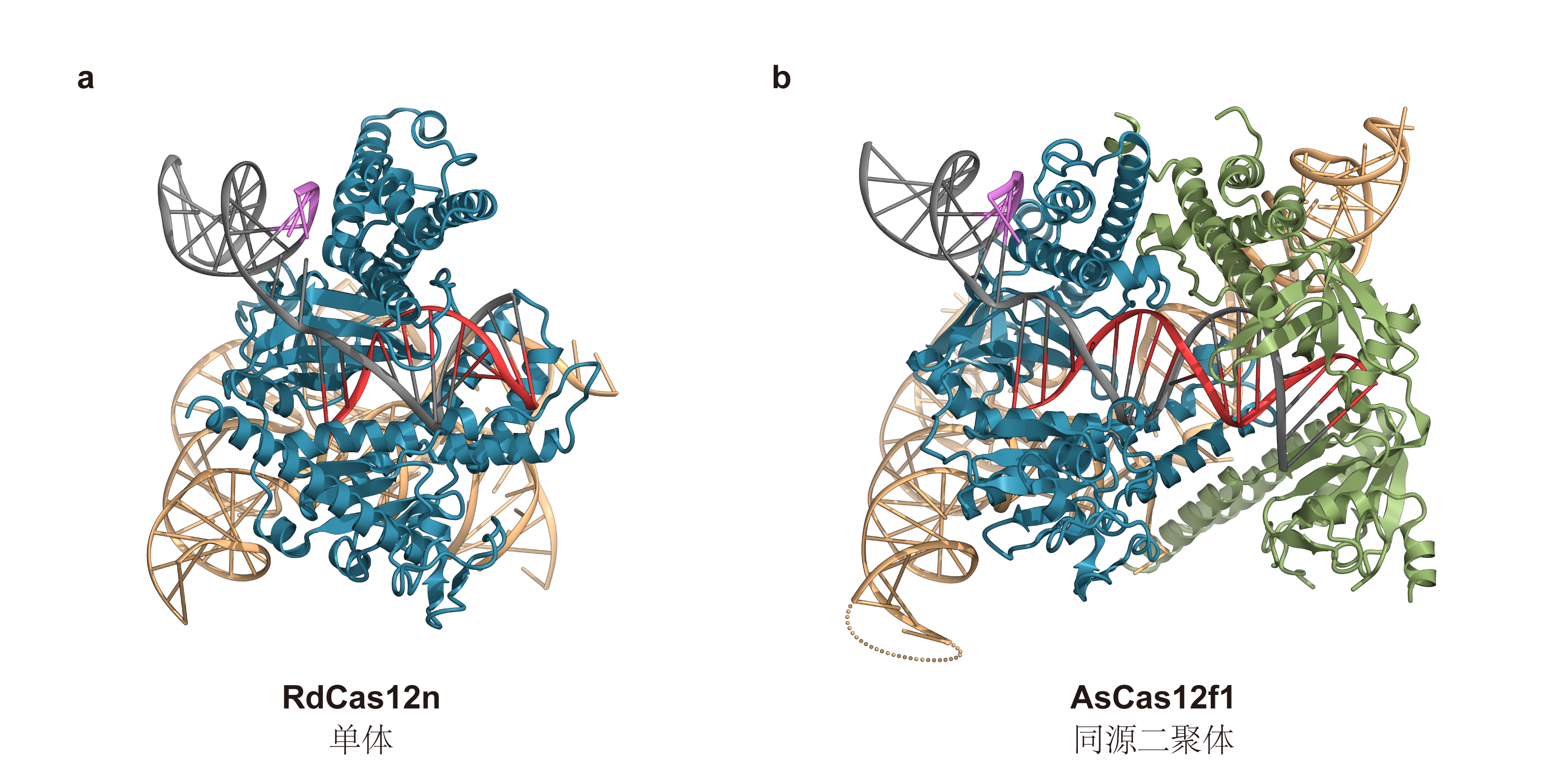
图1:RdCas12n复合体与AsCas12f1复合体的结构比较
a. RdCas12n–sgRNA–dsDNA三元复合体结构。单个RdCas12n分子与引导RNA和目标DNA共同形成效应复合物,仅以单体形式发挥功能,PAM远端暴露于溶剂中。b. AsCas12f1–sgRNA–dsDNA三元复合体结构。两个AsCas12f1分子协同与引导RNA和目标DNA形成效应复合物,通过二聚化将PAM远端包裹在B分子内部。结构图中,dsDNA以灰色表示,PAM序列区域以紫色高亮;RNA以浅橙色表示,guide序列部分以红色高亮。RdCas12n分子用蓝色表示,NUC结构域为AF3预测结构。AsCas12f1的A分子用蓝色表示,B分子用绿色表示。
研究还发现,RdCas12n的sgRNA呈现出多茎环结构的同轴RNA螺旋,其稳定构象对酶的活性至关重要。与Cas12家族核酸酶以及祖先TnpB核酸酶的分子结构对比表明,RdCas12n可能是V型CRISPR-Cas系统进化的早期中间形态,这为探究其进化路径提供了关键证据。
基于结构解析结果,研究人员对系统进行了优化,设计出高效sgRNA变体,显著提升了人类细胞的编辑活性。此外,团队通过移除RdCas12n的催化域(NUC),成功构建了仅含270个氨基酸的超紧奏效应器N-RdCas12n。实验证实,该精简版本仍能精确识别目标DNA,并在细菌中展现出基因激活(CRISPRa)能力,为开发更高效的递送友好型基因编辑工具奠定了基础(图2)。
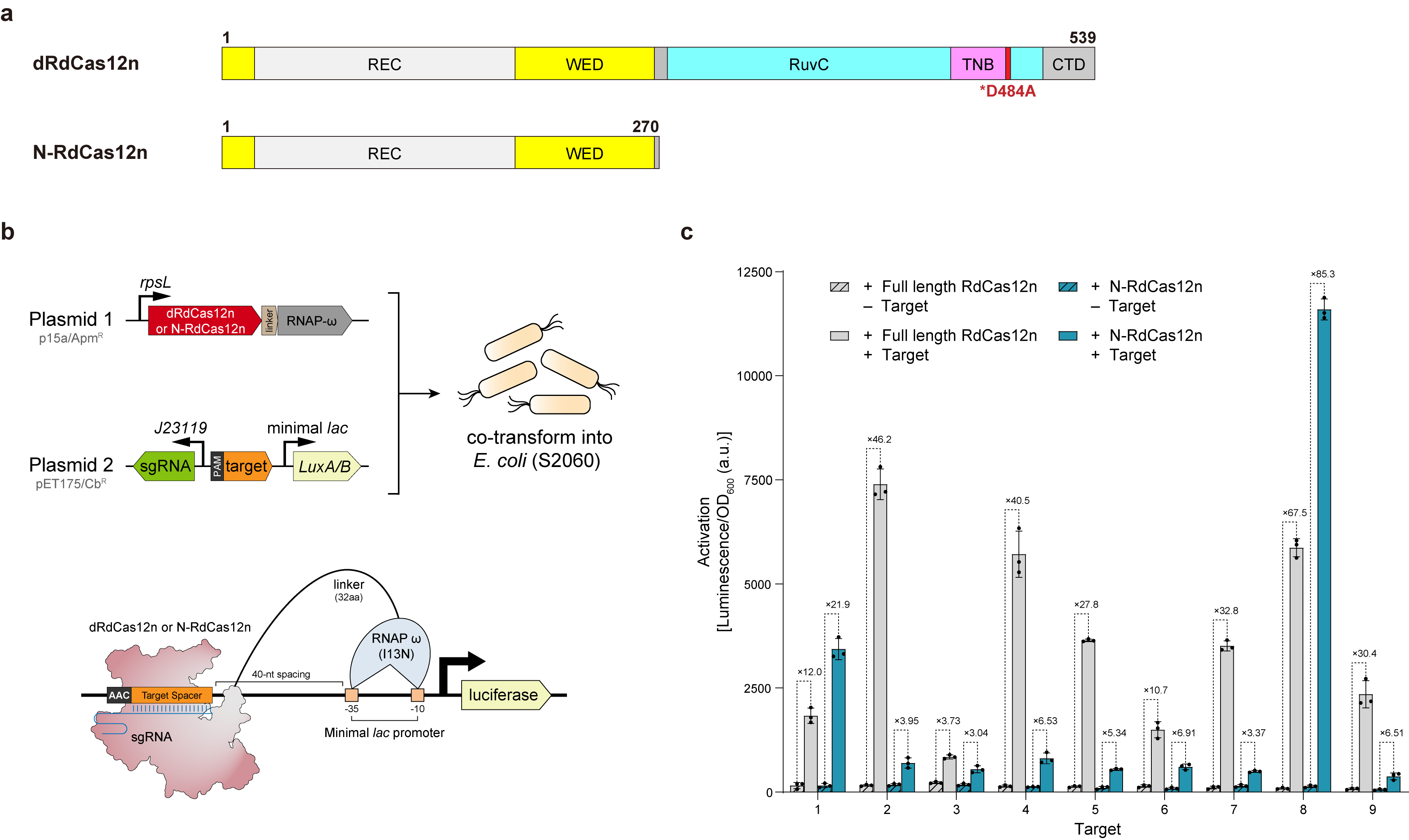
图2:N-RdCas12n的工程改造与其CRISPRa应用示意。
a. 展示了本研究中用于CRISPRa的dRdCas12n和超紧奏效应器N-RdCas12n。b. 转录激活实验流程示意:含有不同CRISPRa效应子与报告基因的质粒共转入大肠杆菌S2060中,靶标DNA结合后激活下游荧光素酶的表达。c. dRdCas12n与N-RdCas12n在9个不同靶点上的转录激活能力对比。数据以平均值±标准差呈现(n=3)。
上海科技大学季泉江课题组博士研究生傅文翰、马佳诚为共同第一作者,季泉江教授为通讯作者,上海科技大学为第一完成单位。
论文标题:Mechanisms and engineering of a miniature type V-N CRISPR-Cas12 effector enzyme


 沪公网安备 31011502006855号
沪公网安备 31011502006855号