内质网转位是分泌蛋白和膜蛋白生物合成的关键步骤,确保这些蛋白质准确定位并发挥功能。然而,信号序列的多样性(体现在序列异质性、构象动态性和转运途径特异性上)对蛋白质转位系统提出了精确识别、高效分选和严格质控的挑战。近日,上海科技大学生命科学与技术学院邹燕与合作者在国际学术期刊《科学进展》(Science Advances)发表了题为“ATP13A1 engages SEC61 to facilitate substrate-specific translocation”的研究论文,报道了P5A型转运体ATP13A1能够协助携带高疏水性和/或缺乏N端正电荷的非典型信号序列的蛋白质通过SEC61通道完成内质网转位,鉴定出ATP13A1负责底物结合与选择的关键氨基酸残基,揭示了该蛋白在确保蛋白质精准高效分选和定位中的重要作用。

P型ATP酶(P-type ATPase)是维持细胞内阳离子和小分子物质不对称分布的重要转运体家族,根据序列特征和底物特异性分为5个亚家族(P1-P5)。其中,P5A亚家族(哺乳动物中为ATP13A1)在被发现后二十多年的时间里,其确切转运底物、门控机制及生理功能都未解析。哺乳动物P5A ATP酶缺失会导致胚胎致死,人类家系研究也表明,ATP13A1的功能降低突变(亚效突变)与智力缺陷、多动症、颅颌面异常等发育问题以及反复呼吸道感染相关。邹燕课题组前期在神经元发育机制的系列研究中发现P5A ATP酶调控分泌蛋白和膜蛋白的内质网转位,但其底物特征和选择机制尚不明确。
为解答这一关键科学问题,邹燕和沃臻生物廖军课题组联合运用细胞生物学、生物化学和结构生物学技术,证实P5A ATP酶ATP13A1调控一类具有高疏水性和/或N端缺乏带正电荷氨基酸残基的非典型信号肽的内质网转位。本研究发现,含有这类信号肽的新生蛋白通过信号识别颗粒(SRP)及其受体复合物,易以错误的拓扑朝向插入内质网膜。随后,拓扑朝向错误的信号肽被ATP13A1拔出,并进一步转交给SEC61转位复合物完成正确转位。研究团队进一步解析了ATP13A1多种构象(分辨率为3.40至3.87 Å)的结构,鉴定了底物结合、特异性及构象转变的关键残基,揭示出ATP13A1底物口袋通过极性作用与信号肽互作的机制。
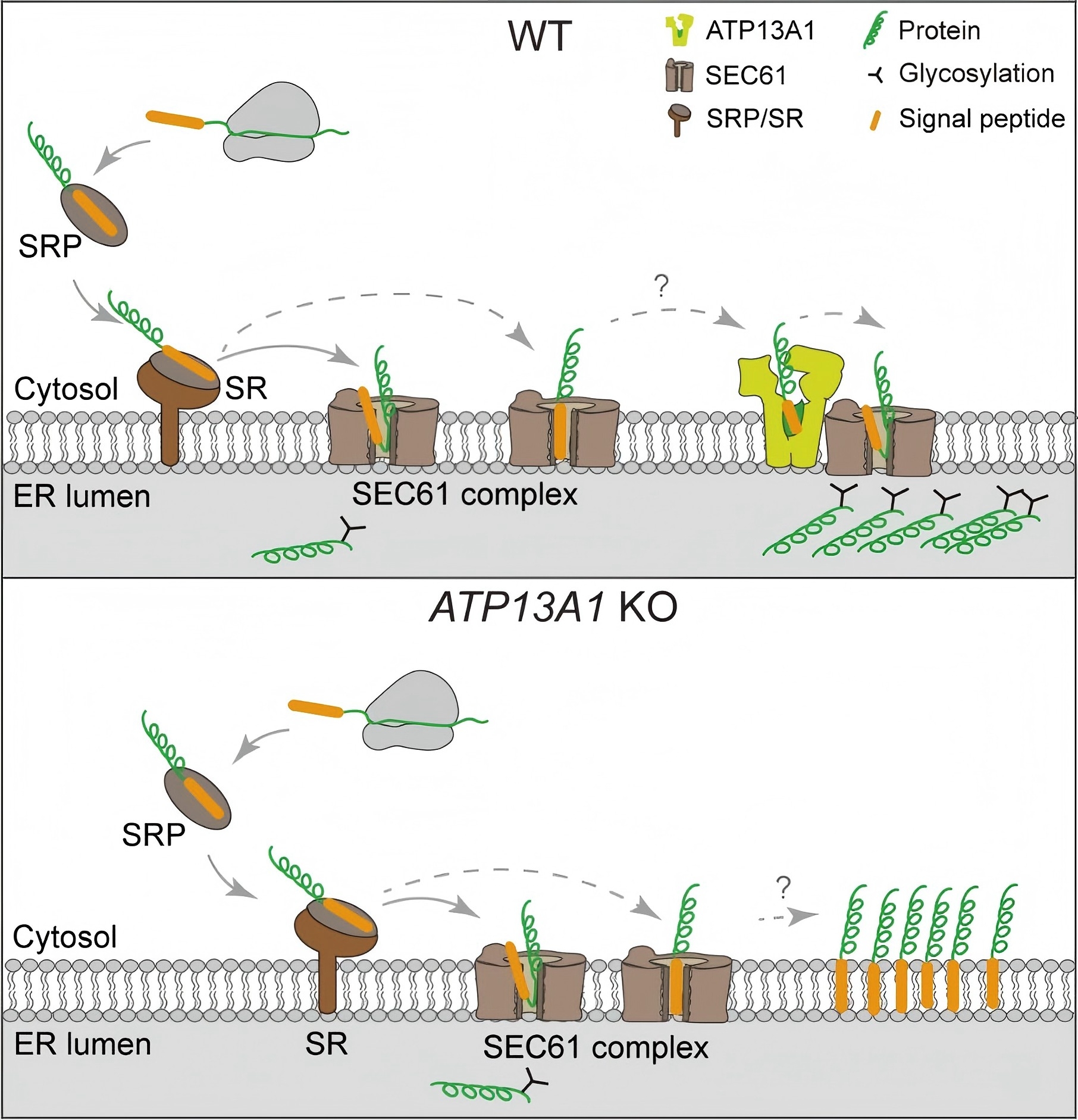
在进化层面上,真核生物中靶向内质网的信号肽相较于原核生物中靶向质膜的信号肽,其N端带正电荷的氨基酸通常较少。这一特征可能有助于避免与细菌来源的线粒体靶向序列发生交叉干扰。真核生物中出现的P5A ATP酶(ATP13A1),通过协调蛋白质质量控制系统和转运机制,为这类易出错的信号肽提供了解决方案。由此,本研究揭示了一条对非典型(易出错)信号肽至关重要的转位调控机制,为理解蛋白质分泌系统如何高效、高保真地应对多样性底物提供了重要见解。
上海科技大学生命科学与技术学院博士毕业生杨小燕、李毅为该论文的共同第一作者。邹燕、廖军及邹燕组博士毕业生丰志刚为共同通讯作者,上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号