10月12日,上海科技大学生命学院范高峰课题组、上海科技大学生命学院/iHuman研究所赵素文课题组,以及中国科学院生物与化学交叉研究中心朱正江课题组合作,在国际学术期刊Cell Reports在线发表了题为“Allosterically inhibited PFKL via Prostaglandin E2 Withholds Glucose Metabolism and Ovarian Cancer Invasiveness”的论文,报道了卵巢癌细胞能通过下调前列腺素合成酶3(PTGES3)的表达使得癌细胞的糖酵解关键限速酶果糖磷酸激酶(PFKL)不再被PTGES3产生的局部浓度的前列腺素E2(PGE2)所抑制,而PFKL活性上调会增强癌细胞的葡萄糖代谢,进而促进肿瘤转移。
在我国的妇科恶性肿瘤中,卵巢癌的发病率位居第三位,却是死亡率最高的妇科恶性肿瘤。肿瘤转移是癌症治疗中面临的最大问题,也是致死的主要原因。因此,发现卵巢癌转移扩散具体的分子机制,以此为基础开发药物并利用药物抑制原位癌的转移扩散以避免进一步恶化和复发,可有效改善患者的生存时间和生活质量。
近年来,肿瘤代谢的改变能影响肿瘤转移这一观念越来越被学术界广泛接受。要想有效地预防,避免和治疗肿瘤转移,就有必要了解肿瘤细胞在转移过程中采取的代谢策略,并加以干预。
本研究首先进行了体外的全基因组CRISPR-Cas9筛选,寻找与卵巢癌细胞侵袭转移相关的基因。对筛选排名第一的候选基因PTGES3开展了进一步研究,对PTGES3的缺失导致的促进卵巢癌细胞系转移侵袭的表型进行了验证和分子机制的解析。
本研究揭示了细胞中新的调控葡萄糖代谢的分子机制。PTGES3可以与PFKL结合,在二者相互靠近的情况下,PTGES3产生的PGE2相较于PFKL而言是局部高浓度的。这种局部浓度的PGE2能够结合并抑制PFKL的活性,使得细胞的糖酵解速率趋于缓和。在卵巢癌细胞中,PTGES3表达下调导致PTGES3-PGE2-PFKL抑制通路缺失,使得PFKL的活性上升,从而上调葡萄糖代谢,进而促进卵巢癌细胞的转移侵袭。
该工作结合分子生物学、细胞生物学、生物化学、生物信息学以及计算生物学等多学科交叉技术手段,通过全基因组CRISPR-Cas9筛选与卵巢癌侵袭相关的基因,为解决卵巢癌转移问题提供了研究靶点。
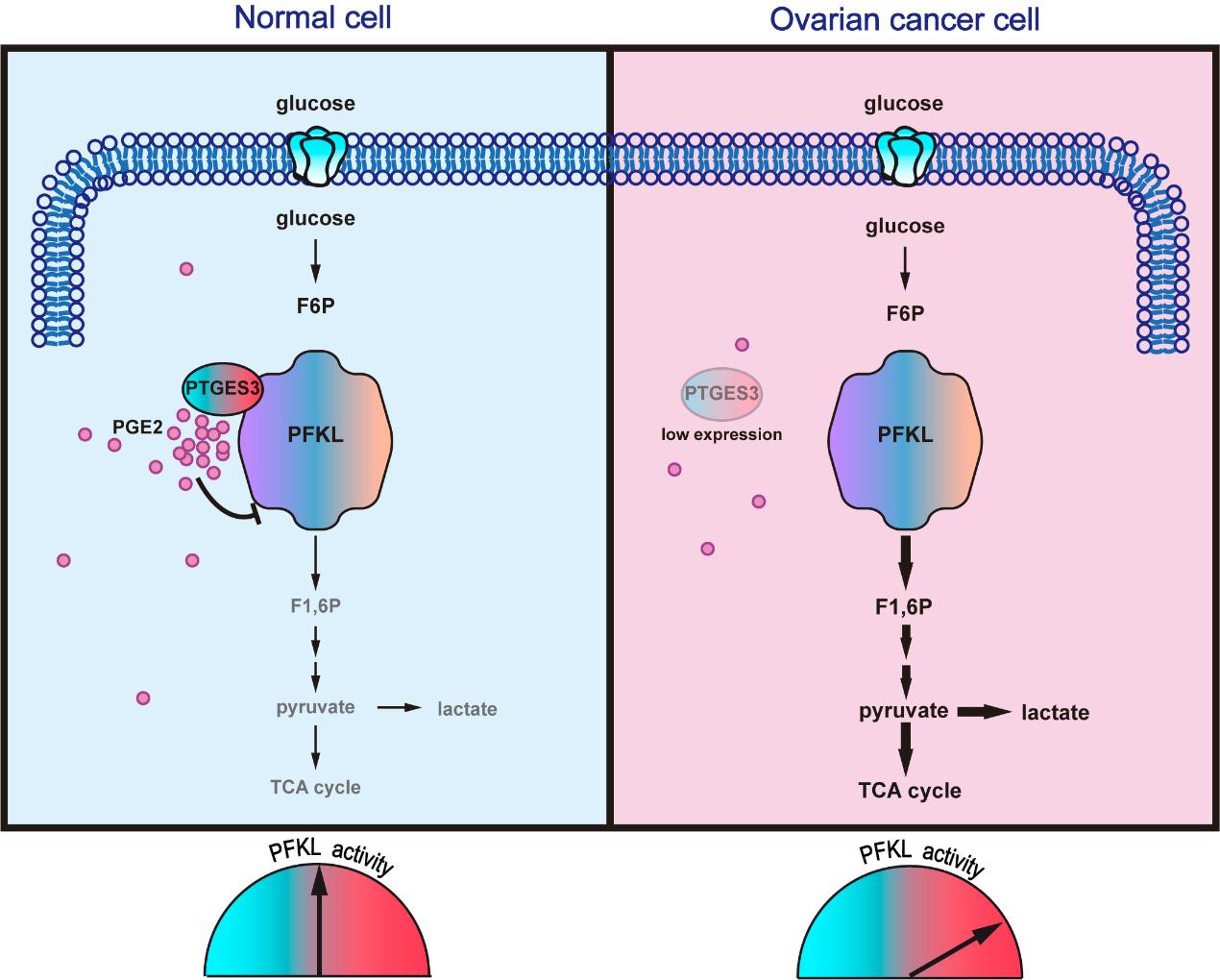
图:PTGES3来源的PGE2抑制PFKL活性的模型示意图
上海科技大学范高峰助理教授、赵素文副教授和中国科学院生物与化学交叉研究中心朱正江研究员为共同通讯作者,上海科技大学范高峰课题组博士生陈胜淼为该论文的第一作者,上海科技大学为第一完成单位。
文章链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01258-5


 沪公网安备 31011502006855号
沪公网安备 31011502006855号