2023年9月11日,上海科技大学生命学院刘冀珑课题组在学术期刊eLife上发表题为“Fat body-specific reduction of CTPS alleviates HFD-induced obesity”的文章。该成果揭示脂肪体中CTPS动态聚合细胞蛇在脂质生成和脂肪组织发育过程中的作用机制。细胞蛇通过整合PI3K-AKT信号通路,感应营养变化和调整代谢适应,进而影响脂质合成基因表达,调控脂代谢稳态。

图1:刘冀珑课题组学术论文“Fat body-specific reduction of CTPS alleviates HFD-induced obesity”在eLife发表。
2010年,在牛津大学工作的刘冀珑教授(现于上海科技大学)于果蝇组织中发现CTPS会形成蛇形无膜细胞器,将其命名为“细胞蛇”(Cytoophidium)。随后CTPS相继在细菌、酵母、古菌和人源细胞系中也形成细胞蛇的现象,表明细胞蛇古老且进化上高度保守。
本研究利用UAS/GAL4系统在果蝇成虫重要的代谢组织包括神经组织和脂肪组织分别特异性地敲低CTPS表达,发现CTPS在果蝇脂肪体中参与体重和饥饿耐受的代谢调节。在高脂营养下,伴随着果蝇增重和脂质堆积的增加,脂肪体中CTPS表达增强,随之形成的细胞蛇长度增加。这些结果提示CTPS能够动态调节细胞蛇组装响应营养变化。深入研究发现脂肪组织特异敲低CTPS表达显著降低幼虫体重和脂肪积累,表现为脂肪细胞和细胞核减小,重要的能量存储分子甘油三脂含量明显减少。
研究者利用点突变特异破坏脂肪细胞中CTPS分子聚合,进而发现CTPS聚合缺失的果蝇在高脂营养下,体重和脂质积累明显少于野生对照果蝇。结合靶向脂质组学和RNA-Seq分析发现CTPS缺失降低脂肪细胞膜PI3K活性,抑制AKT 磷酸化水平,进而调节关键脂质合成酶Acc和FASN1的基因表达。
这一系列实验结果揭示细胞蛇缺失抑制高脂营养诱导的脂质堆积的分子机制,证实CTPS通过PI3K-AKT通路在脂质生成和调控脂肪细胞脂质平衡中扮演至关重要的角色。
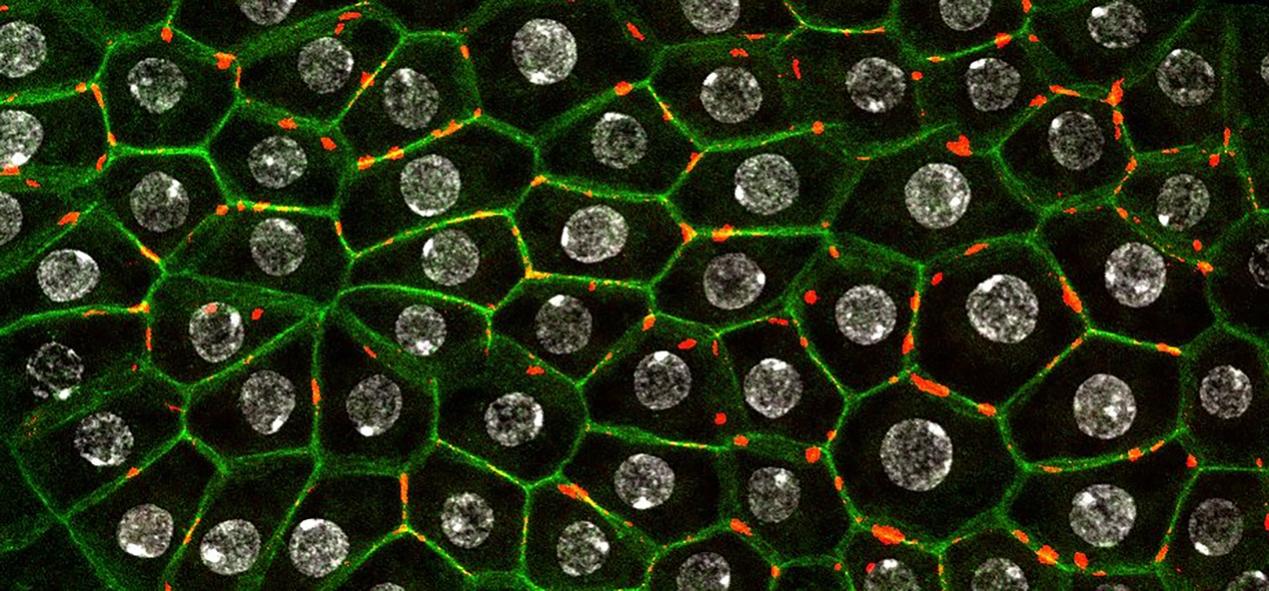
图2:细胞蛇(红色)常常分布在果蝇脂肪体细胞边界。
该研究阐明CTPS动态组装参与果蝇响应生长发育和外界营养变化的能量利用以及与PI3K-AKT信号通路协调控制脂质代谢的生理功能和分子机制。这项工作有助于加深了解哺乳动物和人类CTPS在脂质代谢中的生理功能,使得通过操控细胞蛇的组装和解聚来减肥成为可能,为人类相关代谢疾病治疗提供新的潜在干预靶点。
上海师范大学刘竞男副研究员(原上海科技大学刘冀珑课题组副研究员)为该论文的第一作者,上海科技大学博士毕业生章元兵博士和王俏琦博士为共同一作,周有芳博士参与了这项研究,刘冀珑教授为该论文的通讯作者。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号