近日,上海科技大学免疫化学研究所杨贝课题组与中国疾病预防控制中心性病艾滋病预防控制中心团队合作在国际学术期刊《自然通讯》(Nature Communications)上发表题为“Structures and immune recognition of Env trimers from two Asia prevalent HIV-1 CRFs”的研究论文,报道了我国HIV-1病毒的主流亚型(即流行重组亚型CRF01_AE和CRF07_BC)的Env蛋白结构与免疫识别特征,揭示了CRF01_AE亚型的Env蛋白在V1区域的独有特征及其与该亚型的广谱中和抗体逃逸能力之间的关系,并阐明了第一株分离自CRF01_AE感染个体的广谱中和抗体的新型中和机制。该研究拓宽了我们对于HIV-1流行重组亚型的认识,为后续针对我国主流HIV-1亚型开展免疫聚焦型疫苗设计和相关广谱中和抗体的应用开发提供了理论依据。
人类免疫缺陷病毒I型(HIV-1)是艾滋病流行的肇因。位于HIV-1病毒表面的Env蛋白三聚体是介导病毒侵染宿主细胞的关键分子,也是病毒颗粒表面唯一可被宿主免疫系统识别的靶标,因而一直是艾滋病疫苗研发的焦点。然而,HIV-1病毒超高的基因组变异性赋予了Env蛋白高度的序列多样性,同时Env蛋白也具有丰富多变的糖基化修饰,这些因素使得艾滋病疫苗的传统研发遭遇巨大困难。近年来,研究人员从极少数HIV-1慢性感染人群中陆续分离获得了一系列广谱中和抗体(bNAbs),它们可以识别Env蛋白表面不容易发生变化的功能性区域,从而对于不同的HIV-1病毒株系均表现出优越的中和效力。广谱中和抗体的发现为困顿中的艾滋病疫苗研发指引了新的方向,促使了结构指导的“免疫聚焦型疫苗策略”在艾滋病疫苗研发中的应用。该策略的核心思想是通过结构指导的反向蛋白质工程设计,在屏蔽无效表位的同时将广谱中和抗体的抗原表位特异性地呈递给宿主的免疫系统,从而使宿主的免疫应答聚焦在这些保守的“免疫脆弱点”区域,进而引发有效和广谱的体液免疫反应来预防未来的感染。
“免疫聚焦型疫苗策略”的开展不仅需要广谱中和抗体抗原表位的指引,也需要对Env蛋白的结构与抗原特征进行全面掌握。当前,针对Env蛋白的结构与抗原特征研究均集中于在欧、美、非洲流行的A、B、C亚型,对于在亚洲尤其是我国占主导地位的流行重组亚型CRF01_AE和CRF07_BC则鲜有相关报道。此外,仅有极少数广谱中和抗体从感染流行重组亚型的个体中分离,且它们的抗原表位与中和机制也尚未得到充分阐释。上述信息的缺乏阻碍了我们对于流行重组亚型Env蛋白的结构与免疫原性的认识,也不利于免疫聚焦型疫苗研发策略在我国的开展及应用,在此背景下,杨贝课题组与合作者开展了深入的研究。
研究团队首先利用单分子冷冻电镜技术与生物大分子质谱全面揭示了CRF01_AE和CRF07_BC代表型株系的Env蛋白结构与糖基化修饰(图1a-c)。随后从上述研究中获得的线索出发,对当前数据库中六千余条不同亚型的Env蛋白的V1区域进行了跨亚型对比和分析。结果显示,相比于其他亚型,CRF01_AE亚型的V1区域长度显著增长(图1d),且糖基化修饰位点数目显著增多(图1e-f)。进一步对中和实验数据和V1区域特征的关联分析则显示CRF01_AE亚型在V1区域的上述特征会明显削弱两类广谱中和抗体(分别靶向Env蛋白的apex与V3区域)对CRF01_AE亚型的中和效果(图1g-h)。上述研究结果提示,应尽量避免在CRF01_AE亚型的流行区域开展靶向Apex或V3区域的免疫聚焦型疫苗或广谱中和抗体的临床试验。
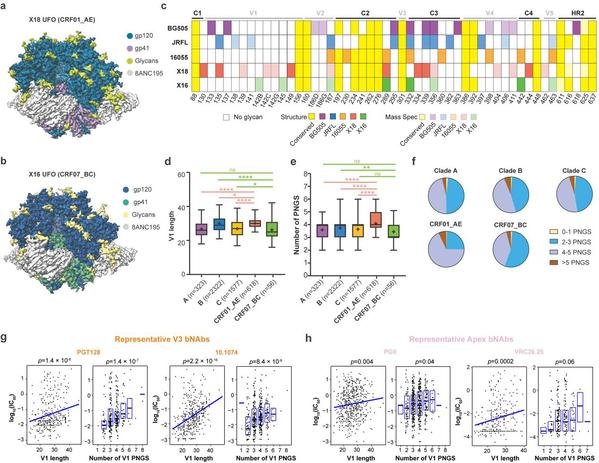
图1、HIV-1流行重组亚型的Env蛋白在V1区域的独有特征及其与广谱中和抗体中和效果的相关性分析。a-b、CRF01_AE(X18)与CRF07_BC(X16)亚型代表株系的Env蛋白高分辨率电镜结构;c、CRF01_AE、CRF07_BC亚型与A(BG505)、B(JRFL)、C(16055)亚型代表株系的Env蛋白糖基化修饰位点比较;d-f、CRF01_AE、CRF07_BC亚型与A、B、C亚型在Env蛋白V1区域的长度与糖基化修饰位点数目差异分析;g-h、病毒在V1区域的长度与糖基化修饰位点数目与靶向V3(抗体PGT128、10.1074)和Apex(抗体PG9、VRC26.25)区域的广谱中和抗体对相应病毒的中和能力之间存在显著负相关。
F6是第一株分离自CRF01_AE感染个体的广谱中和抗体。研究团队还通过高分辨率冷冻电镜结构解析揭示了F6在Env蛋白上的详细抗原表位(图2a),并进一步通过结构分析与功能实验验证阐明了F6的新型中和机制(图2b):F6一方面通过变构效应扰动Env蛋白三聚体Apex区域的稳定性,破坏Env蛋白与宿主CD4受体的结合,另一方面通过诱导三聚体的解体来阻碍Env蛋白介导的病毒包膜与细胞膜的融合,进而抑制病毒对于宿主的入侵(图2b)。
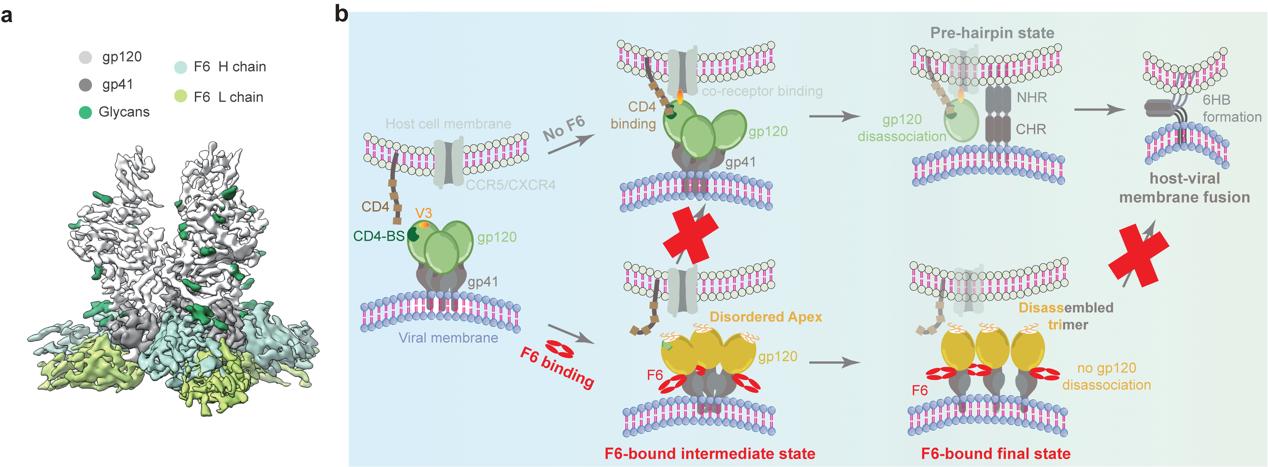
图2、广谱中和抗体F6的抗原表位与中和机制模型。a、F6与CRF01_AE(X18)Env蛋白的高分辨率电镜结构;b、F6的双重中和机制示意图。
上科大免化所/生命科学与技术学院2023届博士毕业生牛军,在读博士生王琪、赵文文,原免化所博士后蒙冰和助理研究员徐有伟为共同第一作者。上科大免化所研究员、生命学院助理教授、上海临床研究中心科学家杨贝与传染病预防控制国家重点实验室副主任邵一鸣教授为共同通讯作者。上海科技大学为第一完成单位。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号