上海科技大学iHuman研究所徐菲课题组在孤儿受体研究上再传捷报,继2020年在Nature发表首个孤儿受体GPR52三维结构后,其研究团队又通过冷冻电镜技术首次解析了孤儿受体GPR21和孤儿受体GPR20的三维结构,分别以“Cryo-EM Structures of Orphan GPR21 Signaling Complexes”和“The activation mechanism and antibody binding mode for orphan GPR20”为题,先后于学术期刊《自然•通讯》(Nature Communications)和《细胞发现》(Cell Discovery)上在线发表。


孤儿受体是一类特殊的GPCR,因其内源性配体尚未被发现而得名,在整个GPCR家族中约有90种。寻找并鉴定其对应的内源性配体的过程即为脱孤。近年来,越来越多的研究报道了孤儿受体在参与介导人体生命活动中的重要生理功能,但由于其内源性配体尚未被发现、相关的工具配体较为缺乏,且孤儿受体与已知结构的GPCR同源性较低,针对孤儿受体的功能探索和结构分析都受到很大的限制,相关研究往往滞后于非孤儿受体。基于结构信息了解孤儿受体特有的激活机制与结构特点,可以促进孤儿受体的功能研究,同时也能够指导内源性配体分子的发现,使得孤儿受体脱孤。因此,研究孤儿受体的结构与机制具有重要的意义。
孤儿受体GPR21几乎在所有组织中表达,尤其在大脑中高度表达。GPR21基因敲除的小鼠相对于野生型小鼠在高脂饮食中会表现出胰岛素敏感性增加、糖耐量提高和促炎性标记物减少,推测GPR21是2型糖尿病和其他代谢紊乱的潜在新靶点。目前,没有任何成熟可利用的GPR21工具配体,该受体结构的解析将为GPR21的配体发现和疾病研究提供精准的结构基础。孤儿受体GPR21与GPR52的序列一致性高达71%,两个受体均具有超高的本底活性,但不同于Gs偶联的GPR52,GPR21下游可以结合多种G蛋白(Gs、Gq和G15/16)。通过结构与功能实验,研究团队发现GPR21与GPR52的ECL2高度保守,ECL2作为内置型激动剂维持了GPR21-G蛋白复合物构像(图1)。此外,该研究还揭示了GPR21新颖的侧位口袋和相对灵活的第六个跨膜α螺旋,阐释了其与经典A家族GPCR不同的激活机制。这些发现均为GPR21的药物发现提供了支撑。
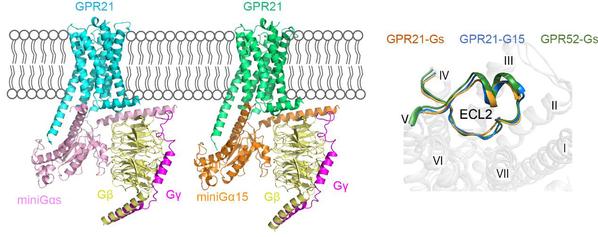
图1.孤儿受体GPR21与下游G蛋白三聚体的复合物结构模型图(左);GPR21与GPR52的胞外环2(ECL2)的比较(右)。
孤儿受体GPR20是A家族的另一个具有高本底活性的Gi蛋白偶联的GPCR。目前针对GPR20的已有研究非常少(仅有6篇论文),这些研究主要发现了GPR20在胃肠道间质瘤(GIST)中高度表达。迄今为止,唯一批准有效的GIST治疗方法是酪氨酸激酶抑制剂,但最终会导致继发性耐药突变,以致疾病继续发生发展。因此GPR20被认为是治疗GIST的非酪氨酸激酶新靶点。徐菲团队利用临床研究中GPR20抗体偶联药物中的特异性抗体辅助解析了GPR20与抗体的复合物结构,以及GPR20在不添加任何配体情况下与下游信号转导蛋白Gi的三维结构。通过分析高分辨率结构,团队首次发现了GPR20独特的N端螺旋(N-cap)伸入跨膜区,并通过一个疏水网络将信号传递到A家族保守的toggle switch上导致了受体的活化,实现了自身的自激活,解释了GPR20受体具有高本底活性的原因(图2)。此外,该精细结构还揭示了GPR20与抗体片段之间具体的分子相互作用,这使得设计具有增强亲和力或新功能的工具抗体成为可能。本研究还发现了一个未知密度占据了GPR20的正构口袋,这为探索GPR20的脱孤和药物研发提供了新线索。
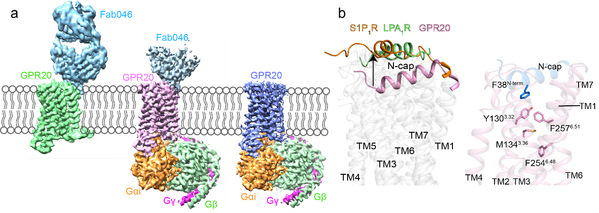
图2.GPR20复合物冷冻电镜密度图(a);GPR20独特的N端帽区(b)
以上两项工作均得到了上科大生物电镜平台和其他技术平台的支持。GPR21研究中,上科大iHuman研究所博士后林浠、助理研究员陈博和副研究员吴屹然为共同第一作者;iHuman研究所研究员、生命学院常任副教授徐菲,iHuman研究所研究员、生命学院常任副教授赵素文和上海药物研究所研究员郑杰为共同通讯作者。GPR20研究中,林浠和生命学院2022级博士研究生蒋姗为共同第一作者;徐菲为通讯作者。两项工作的第一完成单位均为上海科技大学。

徐菲课题组团队
(一排左二:蒋姗;一排左四:林浠;一排左五:徐菲;二排左五:陈博)


 沪公网安备 31011502006855号
沪公网安备 31011502006855号