11月2日,上海科技大学生命科学与技术学院王华翌课题组和中国科学院分子细胞科学卓越创新中心孙丽明课题组合作在Cell Research期刊在线发表题为“Spontaneous necroptosis and autoinflammation are blocked by an inhibitory phosphorylation on MLKL during neonatal development”的论文,首次发现程序性细胞坏死(Necroptosis)的执行蛋白MLKL存在一个物种间保守的抑制性磷酸化修饰,通过阻断MLKL的膜转运而抑制细胞坏死的发生;其作为程序性细胞坏死在执行膜裂解之前的重要检查点(checkpoint),保护机体出生后免受过度的细胞坏死造成的炎性损伤而发挥重要的作用。

程序性细胞坏死可以被炎症因子、病原相关分子模式(PAMP)等多种因素触发。其关键节点是激酶RIP3的活化和其对坏死执行蛋白MLKL的磷酸化激活。被RIP3磷酸化的MLKL继而发生寡聚化并转位到细胞膜,直接造成细胞膜损坏,最终导致细胞的坏死。程序性细胞坏死的典型特点是细胞膜破裂、细胞内容物释放并引起周围组织的炎症反应。过度的程序性细胞坏死在癌症、炎症性疾病、感染性疾病等众多疾病条件下参与诱导组织和器官的炎症性损伤。因此,程序性细胞坏死在正常的机体组织中是被严格调控的。但目前对于其负调控机制还知之甚少。
细胞存活性实验验证了人源MLKL的83位点丝氨酸(S83)的磷酸化抑制MLKL介导的细胞坏死。进一步的细胞生物学及生物化学实验证明,S83的磷酸化不依赖于RIP3且不影响上游RIP3对MLKL的C端造成的磷酸化激活,而是通过直接抑制MLKL的N端寡聚化,进而阻止MLKL转位到细胞膜造成细胞坏死。
通过序列比对,研究人员发现对应人源MLKL的S83氨基酸位点在哺乳动物中高度保守。利用同源位点磷酸化模拟突变小鼠,研究者们验证了在细胞水平和动物损伤性疾病模型中,S82的磷酸化修饰同样具有抑制细胞坏死的功能。有趣的是,在S82位点磷酸化功能缺失性突变的小鼠中,其纯合子后代有大约15%的幼仔在哺乳期陆续死亡,并伴有肺、肝脏等多器官的严重炎症损伤,以及程序性细胞坏死标记物p-MLKL(S345)上调。这说明鼠源MLKL S82位点的磷酸化,在小鼠出生后发育过程中,阻止了自发性程序性细胞坏死造成的炎性损伤。此外,存活下来的小鼠的多个器官中也检测到轻微的炎症和细胞坏死;随着发育到成年,这些小鼠MLKL的mRNA水平和蛋白水平显著下降且多器官炎症消失。这提示细胞坏死过度激活的小鼠中可能存在转录和翻译水平上的调控机制来减少细胞坏死的发生。
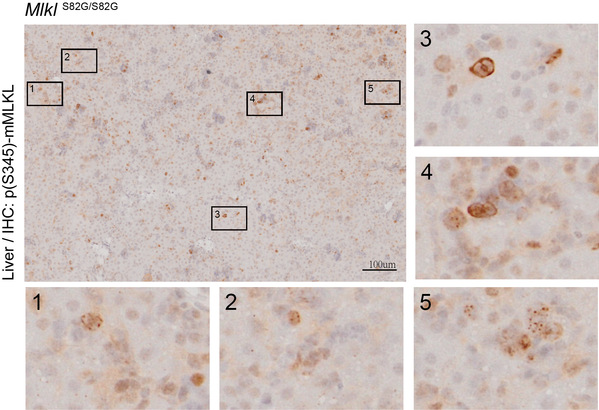
图. MLKL抑制性磷酸化功能缺失突变(MlklS82G/S82G)小鼠肝脏发生程序性细胞坏死。免疫组化显示肝细胞膜上出现被RIP3激活的MLKL(pS345)信号。
本论文中,王华翌课题组博士研究生朱新新为第一作者,王华翌教授和孙丽明研究员为该项研究的共同通讯作者,上海科技大学为第一完成单位。该项研究获得国家自然科学基金及上海科技大学经费的资助,并得到上科大生命学院分子细胞平台、分子影像平台、国家蛋白质科学中心(上海)分子平台和中国科学院分子细胞科学卓越创新中心细胞生物学平台的大力支持。
文章链接:https://www.nature.com/articles/s41422-021-00583-w


 沪公网安备 31011502006855号
沪公网安备 31011502006855号