近日,生命学院刘如娟课题组在知名学术期刊Nucleic Acids Research在线发表题为THUMPD3-TRMT112 is a m2G methyltransferase working on a broad range of tRNA substrates 的研究论文。首次揭示人源THUMP domain-containing protein 3 (THUMPD3) 在甲基转移酶激活辅助蛋白(TRMT112)的协助下,广泛催化转移核糖核酸(transfer RNA,tRNA)上第6和第7位的N2-甲基鸟苷酸(m2G)修饰。该论文不仅介绍了甲基转移酶THUMPD3复合物的催化位点及作用形式,同时也为tRNA:m2G的生物学功能的研究提供了分子基础。

在基因表达过程中,tRNA借由自身的反密码子识别mRNA上的密码子,将该密码子对应的氨基酸转运至核糖体合成中的多肽链上。tRNA是目前已知细胞内含有修饰类型最多、修饰最密集的RNA分子,一个tRNA分子携带 11-13个修饰。虽然早在数十年前多种tRNA修饰就已被鉴定,但是tRNA修饰酶基因的研究工作却远远落后,目前约25%的人tRNA修饰酶仍有待揭示。近些年,越来越多的研究表明,tRNA上广泛存在的甲基化修饰,在多种生命活动中发挥着调控代谢、免疫等一系列非经典功能。
有趣的是,一些tRNA在鲜少发生修饰的氨基酸接受茎处第6位核苷酸存在保守的m2G (N2-methylguanosine)修饰。近期研究表明,在饮食代谢异常小鼠精子中发现tRNA来源的小分子RNA片段 (tRFs)的m2G及m5C修饰水平显著升高,提示两种修饰在tRFs介导的父系代际遗传过程中发挥重要的作用。虽然已有文献揭示了tRNA:m5C在哺乳动物中的作用,但是,目前对tRNA上m2G的发生机制少有研究,尤其是对m2G修饰酶的鉴定。
该论文首次报道了负责催化真核生物中tRNA: m2G6/7的甲基转移酶复合物THUMPD3-TRMT112,为揭示包含THUMP结构域蛋白的识别机制,以及广泛的甲基转移酶激活辅助蛋白TRMT112的结合底物蛋白提供了新的认识。值得一提的是,刘如娟教授与芝加哥大学何川教授在今年7月份合作发表于Nature Cell Biology的论文揭示去修饰酶Alkbh7可以对m2G的进一步甲基化修饰产物m22G进行去除,Alkbh7以及其同家族成员可否对tRNA: m2G6/7进行去修饰的动态调控是值得进一步关注的科学问题。
本论文中,刘如娟课题组2019级博士研究生杨文清为第一作者,刘如娟教授为本文的通讯作者,上科大为第一完成单位。来自上科大免疫化学研究所、中科院分子细胞科学卓越创新中心和海南大学等单位的合作者参与此项研究。上科大生命学院/免化所杨贝教授、生命学院廖军教授对本文提供了昆虫细胞培养的技术支持。上科大分子细胞平台、组学分析平台和分子影像平台的工作人员对本文提供了技术帮助。该研究工作得到了国家重点研发计划、国家自然科学基金以及上科大科研启动基金的经费支持。
论文链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkab927/6406473
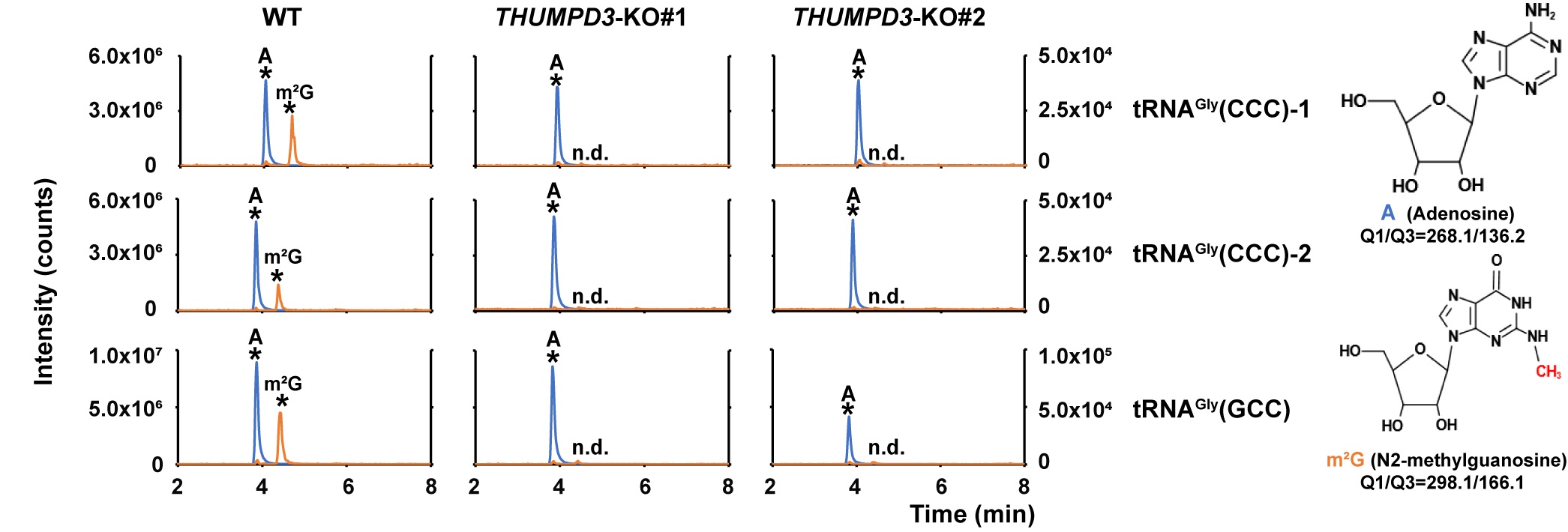
图:HEK293T细胞中THUMPD3基因敲除后,tRNAGly(CCC)-1,tRNAGly(CCC)-2和tRNAGly(GCC)的m2G修饰下降到无法检测的水平。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号