7月23日,上海科技大学生命学院刘冀珑实验室在《美国国家科学院院刊》(PNAS)上发表了研究论文 “CTP合酶配体结合模式的结构基础”(Structural basis for ligand binding modes of CTP synthase)。这项研究以近原子分辨率(2.48埃和2.65埃)揭示了三磷酸胞苷合酶(CTP合酶)配体结合模式,是近70年的CTP合酶研究中,第一次用可靠的电子密度图精确定位该代谢酶结构中的所有配体。
研究团队通过近原子分辨率的结构信息,不仅揭示了四种不同核苷酸及底物谷氨酰胺与CTP合酶的精准相互作用,也完善了人们对CTP合酶变构调节及CTP合成的潜在机制的理解。
CTP合酶是生物化学教科书上解释酶与底物相互作用的经典案例,它催化从头CTP生物合成的最后一步和限速步骤,其配体包括ATP、GTP、UTP和CTP这四种基本核苷酸以及谷氨酰胺和谷氨酸这两种氨基酸。
CTP合酶在促进活跃的细胞代谢中起着关键作用,特别是在增殖细胞(如干细胞、如淋巴细胞和癌细胞)中,其表达和活性上调。因此,CTP合酶一直被认为是治疗寄生虫感染、病毒感染和癌症等疾病的潜在药物靶点。
2010年,牛津大学刘冀珑实验室(现于上海科技大学)于果蝇组织中发现CTP合酶会形成一种线状的大型无膜结构,并将其命名为“细胞蛇”(Cytoophidium)。随后CTPS细胞蛇相继在细菌、酵母、古菌和人源细胞系中被发现,显示细胞蛇的形成在生命的演化上高度保守,并可能具有重要的生物学功能。
尽管对CTP合酶的研究已有70多年的历史,但谷氨酰胺水解和CTP合成过程中配体结合和构象变化的细节仍不清楚。在此研究中,刘冀珑教授团队利用谷氨酰胺类似物6-重氮-5-氧代-L-去甲亮氨酸(DON)将果蝇CTP合酶固定在催化反应发生当下的结构型态,获得了完整CTPS四聚体的三维结构,更将分辨率提升至近原子水平的2.48埃。
利用这个模型,他们首先揭示 GTP结合位点,并证明GTP在介导谷氨酰胺结合、NH3转运和稳定氨通道中的作用。此外,研究者还捕捉到了依赖ATP的UTP磷酸化的催化中间态,并确定与之相互作用的氨基酸,验证了过去研究对此反应机理的推想。
出乎意料的是,该团队发现了CTP合酶上的第二个CTP结合位点。第二个CTP结合产生了这样一个概念:CTP通过与UTP和ATP竞争来阻断CTP合酶,从而使反馈抑制达到新的复杂程度。
该论文获得两位审稿人的高度评价。其中一位审稿人说:“大量已知的配体,以及CTP合酶高度调控的事实,使得CTP合酶在其反应周期中获得多种构象,并形成可逆的纤维结构,根据物种和/或异构体捕获不同的构象,(这些特征)使CTP合酶成为研究嘧啶生物合成和酶的通用结构调控的肥沃土壤”。
该审稿人还表示,“对酶调节、嘧啶生物合成和药物开发感兴趣的读者会发现这项工作很重要,很可能会从他们那里获得许多引用”。
上海科技大学生命学院高级工程师周贤、2020级硕士研究生郭陈君与博士后张家骏为该论文的共同第一作者,刘冀珑教授为该论文的通讯作者。这项研究获得上海科技大学和国家自然科学基金的资助以及上海科技大学电镜平台和生命学院分子细胞平台的技术支持。
论文链接:https://doi.org/10.1073/pnas.2026621118
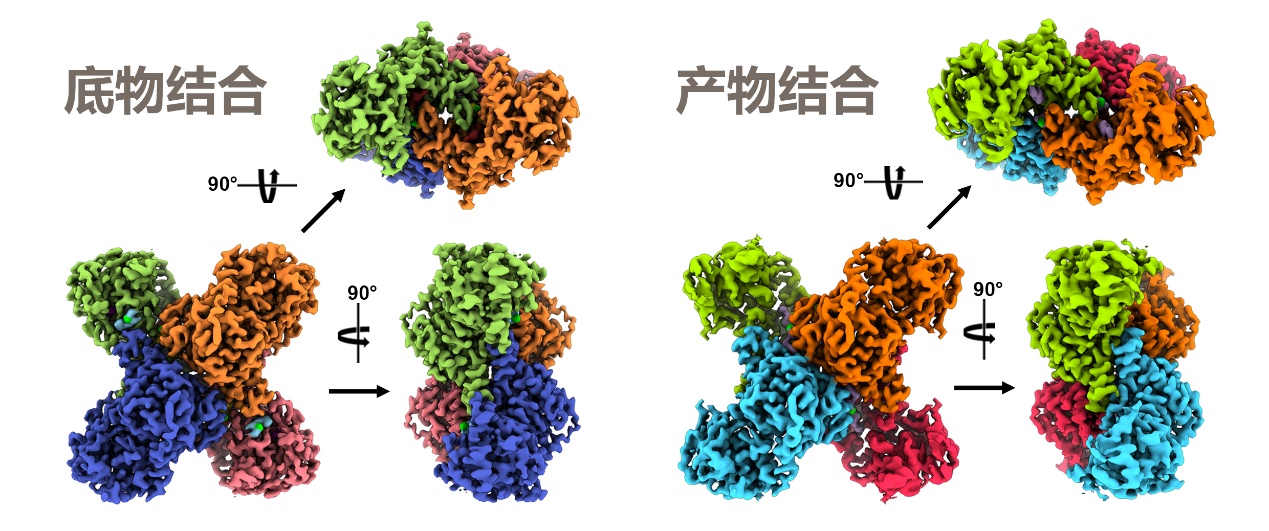
底物结合和产物结合的CTP合酶四聚体形成迥异构象

刘冀珑实验室结构小组(左一为刘冀珑)


 沪公网安备 31011502006855号
沪公网安备 31011502006855号