上科大iHuman研究所徐菲课题组在癌症药物靶点卷曲受体研究上再传捷报,继2018年在Nature上发表第一个卷曲受体FZD4结构,其研究团队又通过冷冻电镜技术首次解析了卷曲受体FZD7和下游G蛋白三聚体复合物结构,以真实可见的三维精细结构破解了卷曲受体领域长期争论的谜题——即此类非经典G蛋白偶联受体(GPCR)能否与G蛋白形成稳定的具有信号传递功能的复合物。该成果以“Cryo-EM structure of constitutively active human Frizzled 7 in complex with heterotrimeric Gs”为题,于7月8日在学术期刊《细胞研究》(Cell Research)上在线发表。

由卷曲类受体介导的Wnt-FZD-βcatenin信号通路,在人体胚胎发育和干细胞分化过程中发挥重要调控作用。FZD7是卷曲受体家族十个蛋白中研究最为深入的一个,在多种癌症,如胃肠癌、乳腺癌、结直肠癌中高表达且参与癌症的发生发展,是新兴的癌症药物靶点。该受体跨膜结构域三维结构的首次破解将为研究靶向性治疗癌症药物提供精准的结构基础。
作为一类非经典GPCR,卷曲受体下游是否激活经典G蛋白通路一直是领域内的争论热点,包括对卷曲受体是否属于GPCR的命名范畴亦有不同意见。徐菲研究团队大胆创新,使用天然序列的人源FZD7蛋白与改造后的G蛋白三聚体进行体外组装,意外发现了稳定的复合物。在上科大生物电镜平台的支持下,研究团队通过冷冻电镜三维重构技术开发自主创新方法,克服数据处理中的多重困难,获得了3.1Å 高分辨结构。根据搭建的原子模型与结构分析证实了该复合物呈现了受体的激活构象,该构象与经典GPCR激活态既有相同又有不同之处,阐释了卷曲受体特有的激活机制。瑞典卡罗林斯卡学院Gunnar Schulte教授团队通过bio-sensor等方法,从功能上验证了该结构的生理意义。本研究不仅从结构上证实卷曲受体存在经典G蛋白信号通路,并且进一步证明了在无配体结合的条件下FZD7可以组成性激活下游G蛋白,从而为开发靶向这类受体的抑制性治疗药物提供了新的思路。
上海科技大学生命学院2018级博士研究生徐鹭和iHuman研究所助理研究员陈博,与合作单位瑞典卡罗林斯卡学院Hannes Schihada,Shane C.Wright为文章共同第一作者;iHuman研究所助理所长、生命科学与技术学院常任副教授徐菲和瑞典卡罗林斯卡学院Gunnar Schulte教授为文章共同通讯作者。上海科技大学为第一完成单位。
文章链接:https://doi.org/10.1038/s41422-021-00525-6
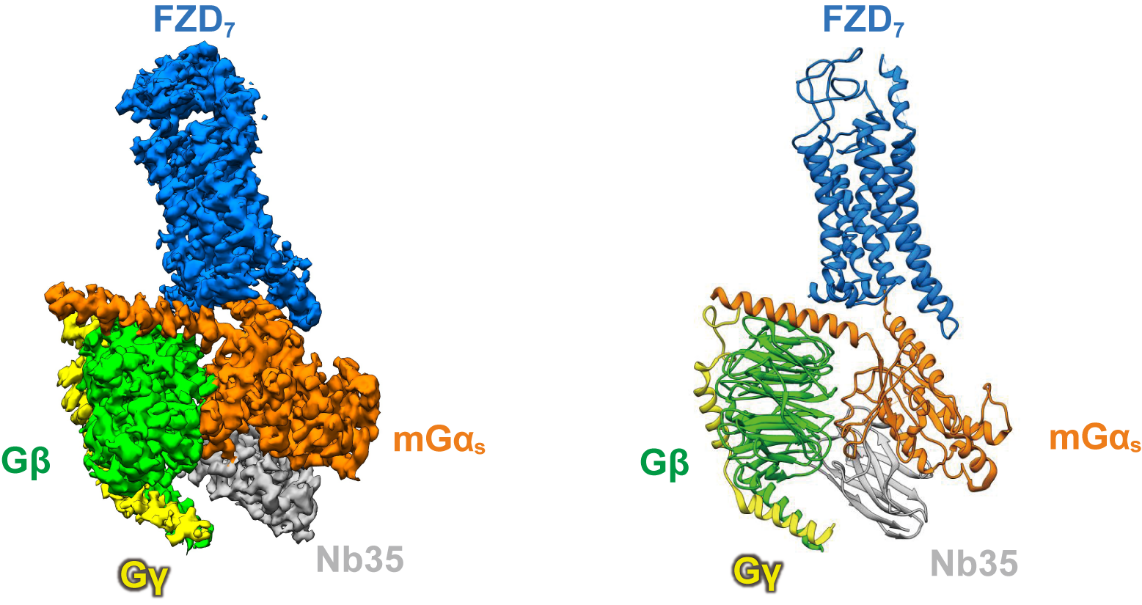
图为卷曲受体FZD7结合下游G蛋白三聚体复合物的三维结构展示图。(左)冷冻电镜密度图;(右)原子模型图。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号