5月10日,国际学术期刊Nature Cell Biology以“Eliminating base-editor-induced genome-wide and transcriptome-wide off-target mutations”为题,在线发表了上科大生命科学与技术学院陈佳教授、上科大生命科学与技术学院/免疫化学研究所杨贝教授、中科院上海营养与健康研究所杨力研究员(我校特聘教授)与武汉大学医学研究院殷昊教授合作研究的最新进展。该研究构建了一种高精准碱基编辑系统,并依据其特性命名为变形式碱基编辑系统(transformer base editors,简称tBEs)。研究人员利用双腺相关病毒载体将tBE系统递送至成年小鼠的肝脏中,显著降低了小鼠血清中PCSK9蛋白表达水平以及总胆固醇水平,并且未在小鼠体内检测到脱靶效应。
根据统计数据显示,碱基编辑器理论上可以通过碱基转换纠正50%以上的人类致病性点突变。然而,sgRNA会引导碱基编辑器错误结合在与靶向位点序列相似的脱靶位点造成脱靶突变。另外,近期多项研究发现碱基编辑器会在全基因组和全转录组范围内引发非常严重的sgRNA非依赖性脱靶突变,并且这些突变随机分布于全基因组中。这些sgRNA依赖性以及非依赖性脱靶突变极大地限制了碱基编辑系统的进一步发展及其在疾病治疗方面的运用。在该项研究中,研究人员创建的tBE可以在脱靶位置处保持“锁定”状态,而只有在靶向位点才能“解锁”进行碱基编辑(图),从而同时消除sgRNA依赖性和非依赖性脱靶效应,全面解决了影响碱基编辑系统进行治疗性应用的脱靶问题。
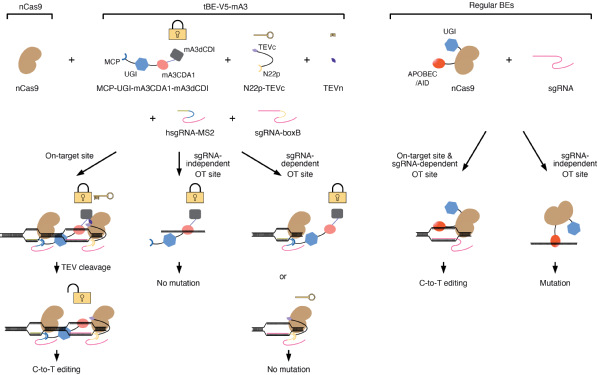
图 tBE-V5–mA3系统在靶向位点进行编辑,不会产生OTss和OTsg。
这一研究成果在基因编辑治疗领域具有重要意义。首先,碱基编辑器能否从科研转化为临床疗法的关键点就是编辑器的脱靶效应和效率。tBE在小鼠体内成功实现靶位点的高效编辑并且没有检测到全基因组和全转录组的脱靶效应,给基因编辑治疗带来一支强心剂。其次,如何对基因编辑工具开展安全有效的体内递送是碱基编辑走向临床的另一个难点。tBE系统的设计构型可以巧妙利用双AAV载体安全地递送到动物体内,实现了精准、高效的靶向编辑。由于PCSK9蛋白的表达与低密度脂蛋白(LDL)水平有关,而LDL水平过高可能产生脑血管疾病、冠心病和外周动脉疾病,以及其并发症包括心肌梗死、缺血性心肌病、心脏性猝死等系列疾病,严重影响心血管健康。目前这类患者只能通过改变生活方式和同时加用他汀类药物的方法进行治疗,并选择性使用胆固醇吸收抑制剂依折麦布或PCSK9的抑制剂,并需长期服药才能维持疗效。该研究成果通过靶向编辑Pcsk9,提前引入终止密码子降低PCSK9的表达,成功降低小鼠体内的LDL的水平,无疑为患者带来了新的治疗希望,理论上可以达到一次治疗终身治愈的效果。
该论文中,陈佳研究组博士研究生王丽洁、杨力研究组博士研究生薛尉、殷昊研究组博士后张红霞、陈佳研究组博士研究生高润泽和殷昊研究组博士研究生邱厚圆为共同第一作者,陈佳、杨力、殷昊和杨贝为共同通讯作者。该项研究得到了科技部、国家自然科学基金委和上科大科研启动基金的支持。
论文链接:https://www.nature.com/articles/s41556-021-00671-4


 沪公网安备 31011502006855号
沪公网安备 31011502006855号