北京时间2月11日零点,Cell出版集团旗下知名学术期刊Molecular Cell(《分子细胞》)以研究长文(Article)的形式,在线发表了上海科技大学免疫化学研究所结构生物化学实验室与斯坦福大学合作者的研究论文,题为“Mediator structure and conformation change”(中介体复合物的结构和构象变化),首次报道了完整中介体复合物(Mediator)的近原子分辨率冷冻电镜结构,及其在结合RNA聚合酶II(Pol II)前后发生的构象变化,为进一步理解中介体复合物参与转录调控的分子机制提供了重要基础,是转录调控这一基础研究领域的重要进展。
基因转录是所有原核和真核生物最基础的生命活动之一,是中心法则的重要一环。真核生物转录与原核生物转录最大的区别在于:负责激活基因转录的转录激活子在原核生物中直接与核心转录机器RNA聚合酶结合;而在真核生物中,转录激活子不直接与Pol II结合,而是由一个被称为中介体的超级复合物介导。换句话说:在真核生物中,中介体复合物在转录激活子和Pol II之间起到一个桥梁的作用。中介体复合物对几乎所有真核生物基因的转录都是必需的。
中介体复合物由2006年诺贝尔化学奖得主Roger D. Kornberg教授实验室发现。1999年,Kornberg实验室在《科学》发表论文,用负染电镜的方法观察到了酿酒酵母和小鼠中介体复合物的大致形状,证明了该复合物的普遍性。自从Kornberg实验室纯化得到中介体复合物后,世界上多个实验室对它的结构生物学研究开展了持续攻关。酿酒酵母中介体复合物包含21个亚基,并且被划分为头部、中部和尾部三个模块。由于成分复杂多变、柔性极强,解析完整中介体复合物高分辨率结构一直是领域内的难题。2011-2017年,中介体头部模块4.3 Å和3.4 Å的晶体结构、中介体复合物头部与中部模块复合物4.4 Å的冷冻电镜结构和3.4 Å的晶体结构先后在《自然》上发表。尽管已有多个中介体亚复合物的高分辨率结构被解析和报道,但是负责与转录激活子直接结合的尾部模块(400 kDa)以及完整中介体复合物始终没有高分辨率结构。由于完整复合物高分辨率结构的缺失,人们对于中介体复合物如何参与转录调控的理解也非常有限。
由于酵母和哺乳动物来源的中介体复合物柔性非常强、结构均一性差,解析该复合物的高分辨率结构难度较大。结构生物化学实验室助理研究员张贺桥另辟蹊径,选择研究来源于嗜热毛壳菌(一种耐热真核生物)的中介体复合物,通过对嗜热毛壳菌进行基因组改造,在Med6羧基端融合了可以用于亲和纯化的标签。通过发酵罐培养,最后从湿重约两公斤的细胞中纯化得到了单独中介体及中介体与Pol II复合物的高质量蛋白样品,并与斯坦福大学医学院结构生物学系高级科学家谌东华合作,利用冷冻电镜解析了完整中介体(6.6 Å)及其与Pol II的复合物结构(4.3 Å)。在中介体与Pol II的复合物结构中,头部模块与中部模块分辨率为4.2 Å,而之前没有任何高分辨率结构信息的尾部模块分辨率达到了3.6 Å。基于该结构,联合研究团队首次在中介体上鉴定到了转录激活子可能的结合位点。此外,通过比较完整中介体及其与Pol II的复合物结构,发现了中介体在结合Pol II前后发生的构象变化:结合Pol II后,尾部模块发生转动,Med1蛋白发生轻微平移,Pol II-CTD(C-terminal domain,羧基端结构域)结合位点处的缺口发生关闭。这些构象变化为理解中介体参与转录调控的分子机制提供了重要启示。
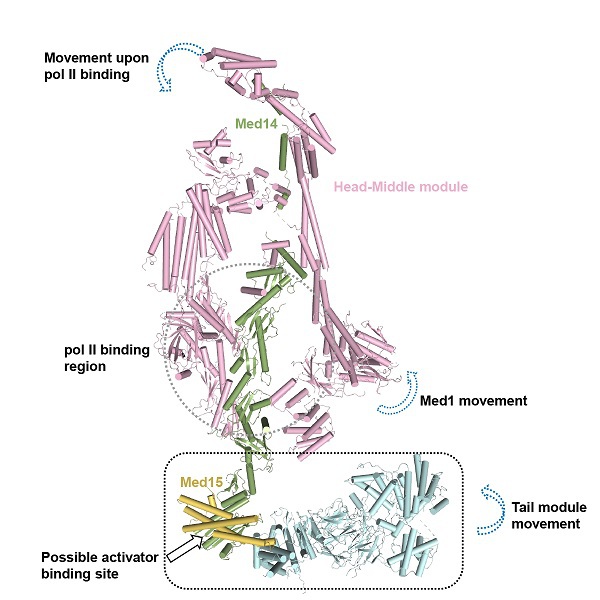
完整中介体复合物的近原子分辨率冷冻电镜结构,及其在结合Pol II前后发生的构象变化。
值得一提的是,本研究在后期遇到了新冠疫情爆发和蔓延的挑战,但联合研究团队通过紧密协作和及时沟通,克服了各种困难,保证了研究的顺利完成。本论文中张贺桥为第一作者,Roger Kornberg为首要通讯作者(lead contact),Co-PI聂焱为共同通讯作者,上海科技大学为第一完成单位。

部分文章作者合影(从左到右:王琳、王春年、张贺桥、Roger D. Kornberg、聂焱、原超、王雁南)


 沪公网安备 31011502006855号
沪公网安备 31011502006855号