10月30日,上海科技大学免疫化学研究所抗结核结构研究中心饶子和/张兵研究团队在国际学术期刊Science Advances 发表了题为 Structural basis of trehalose recycling by the ABC transporter LpqY-SugABC 的研究成果。该工作借助上海科技大学生物电镜平台,运用单颗粒冷冻电镜技术,解析了分枝杆菌中特异性海藻糖摄取机器LpqY-SugABC处于四种不同转运状态的高分辨率三维空间结构,揭示了海藻糖跨膜转运进入胞内的精确分子机制。这项研究为理解革兰氏阳性菌中ABC 转运蛋白(ABC transporter)的工作机理和海藻糖类抗结核药物的研发奠定了重要的基础。

结核病是由病原体结核分枝杆菌 (简称结核杆菌)感染引发的一种致命性疾病,每年造成数百万人的死亡,是单一传染病中的“头号杀手”。目前,全球仍有约1/4的人口被结核杆菌感染,但治疗结核病的一线药物均为上世纪40-60年代开发,使用已长达半个多世纪。近年来,由于艾滋病与结核病的交叉感染以及药物的不合理使用,已经产生了严重的耐药结核病,对当前的治疗药物和治疗方法产生了严重的冲击,造成了全球公共卫生危机。因此,针对抗结核药物靶点的研究以及新药的研发迫在眉睫。
在分枝杆菌(包括病原体结核杆菌)中,ABC内向转运系统(ABC importer)LpqY-SugABC与分枝菌酸转运体MmpL3(2019年该研究组解析了该重要药物靶点的三维结构(Cell,DOI:10.1016 /j.cell.2019.01.003))形成了完整的海藻糖转运回路。海藻糖作为这些病原体细胞壁上重要糖脂的关键组分,对病原体的生存和致病性至关重要。因此,海藻糖类抗结核药物的研发对于结核病的治疗具有很大的潜力。在结核杆菌中,LpqY-SugABC是海藻糖专一性的摄取通道,也是海藻糖类衍生物进入病原体内的唯一路径,故而是抗结核新药研发的潜在靶点。然而,该转运机器如何识别海藻糖以及如何实现海藻糖跨膜转运的分子机制仍然未知,这都极大的限制了对该靶点的认知和海藻糖类抗结核药物的研发。
在本研究中,饶子和院士研究团队运用单颗粒冷冻电镜技术解析了耻垢分枝杆菌中特异性转运海藻糖的ABC importer LpqY-SugABC在前静息状态(pre-resting state)、静息状态(resting state)、前移位状态(pre-translocation state)和催化中间态(catalytic intermediate state)共四个功能状态的高分辨率三维空间结构。基于底物海藻糖和ATP结合后诱导的一系列构象变化,揭示了极性小分子海藻糖跨膜转运到细胞内的精确分子机制。该工作首次完整的描绘了革兰氏阳性菌中ABC importer的工作模型。相较于革兰氏阴性菌和古细菌中已有相关研究报道的ABC importers,海藻糖摄取机器LpqY-SugABC的新颖特征是底物结合蛋白LpqY可以在未结合海藻糖时和转运体SugABC形成稳定的复合体,同时LpqY的N-末端通过脂修饰嵌合在细胞膜上。海藻糖的摄取是通过底物结合蛋白LpqY相对于转运体SugABC的枢轴旋转来实现。更为重要的是,在整个转运过程中底物结合蛋白LpqY与转运体SugABC作为一个整体稳定存在。这种模式可能在涉及脂修饰的底物结合蛋白的ABC importers中广泛存在。
该研究不仅揭示了分枝杆菌(包括病原体杆菌)摄取重要营养物质海藻糖精确的分子机制,更为重要的是,提供了高精度的LpqY-SugABC的原子坐标,将为后续海藻糖类抗结核药物的设计奠定重要的结构基础。同时,该研究发现的独特的处于静息状态的(resting state)的ABC importer的结构特征和底物结合蛋白抓取底物时相对于转运体枢轴旋转的构象变化将极大的丰富对ABC转运蛋白这一重要膜蛋白家族功能机制的理解。
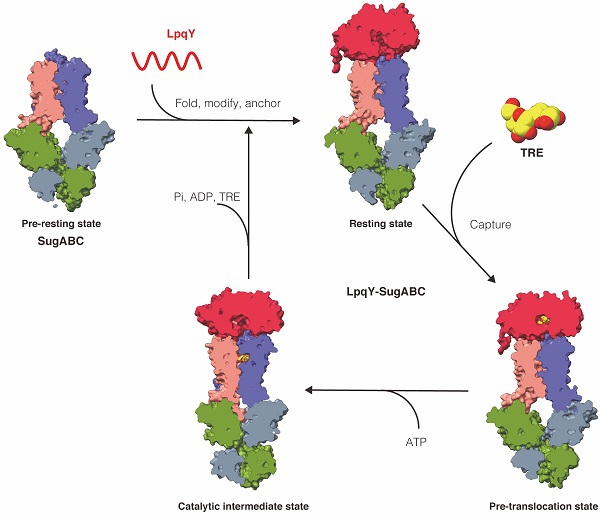
分枝杆菌中海藻糖的跨膜转运机制
饶子和院士团队长期致力于新发、再发传染性疾病病原体的结构生物学研究及新药开发,这是该研究团队继年初揭示一线抗结核药物乙胺丁醇作用机制(2020年 Science )后在抗结核领域取得的又一重要研究成果。上海科技大学博士研究生刘凤江,南开大学博士研究生梁静茜和清华大学博士-上科大访问学生高岩为本文的共同第一作者。免化所副研究员、抗结核结构研究中心PI张兵为论文的并列第一作者兼共同通讯作者,免化所特聘教授、抗结核结构研究中心名誉主任饶子和院士为本文的共同通讯作者。上海科技大学为第一完成单位。同时,上科大生命学院教授许文青,免化所研究员杨海涛和副研究员杨秀娜也参与了此项研究。该研究得到了科技部重点研发计划和国家自然科学基金的大力支持。
原文链接: https://advances.sciencemag.org/content/advances/6/44/eabb9833.full.pdf


 沪公网安备 31011502006855号
沪公网安备 31011502006855号