近日,上海科技大学iHuman研究所Kurt Wüthrich课题组在《美国国家科学院院刊》(The Proceedings of the National Academy of Sciences,PNAS)发表论文,揭示了神经激肽1受体(NK1R)与小分子配体阿瑞匹坦(aprepitant)结合时正构口袋的大尺度运动。
G蛋白偶联受体(GPCR)是细胞膜上具有七次跨膜螺旋的一类蛋白质,它结合细胞外环境中的信号分子并传递信息到细胞内部,进而产生响应。近年来,科研人员通过X射线晶体学和冷冻电子显微镜技术解析了大量GPCR的三维结构。这些受体结合不同效应配体后,胞外侧的配体结合口袋及胞内侧跨膜螺旋有明显的构象变化。结合口袋的收缩或扩张与配体的类型及结合模式密切相关,是GPCR结构与功能研究的热点之一。
通过19F核磁共振观测结合于神经激肽1受体正构口袋的配体阿瑞匹坦,发现阿瑞匹坦两个对称的三氟甲基处于不同的微环境并有多个亚状态。通过2D [19F, 19F]-EXSY和19F饱和转移实验,发现连接三氟甲基的苯环存在翻转的现象(图1)。苯环翻转所需的空间远大于现有结构中显示的两个跨膜螺旋间距离,表明了其在这一位置的收缩至少有6 Å,而比较已解析的GPCR与拮抗剂和激动剂配体结合的三维结构,显示在结合口袋内部这两个位点间伸缩的幅度在0.3–2.9 Å。因此,结合口袋内部大尺度的运动是溶液环境下发生的,静态结构目前还不能完全显示这种状态。
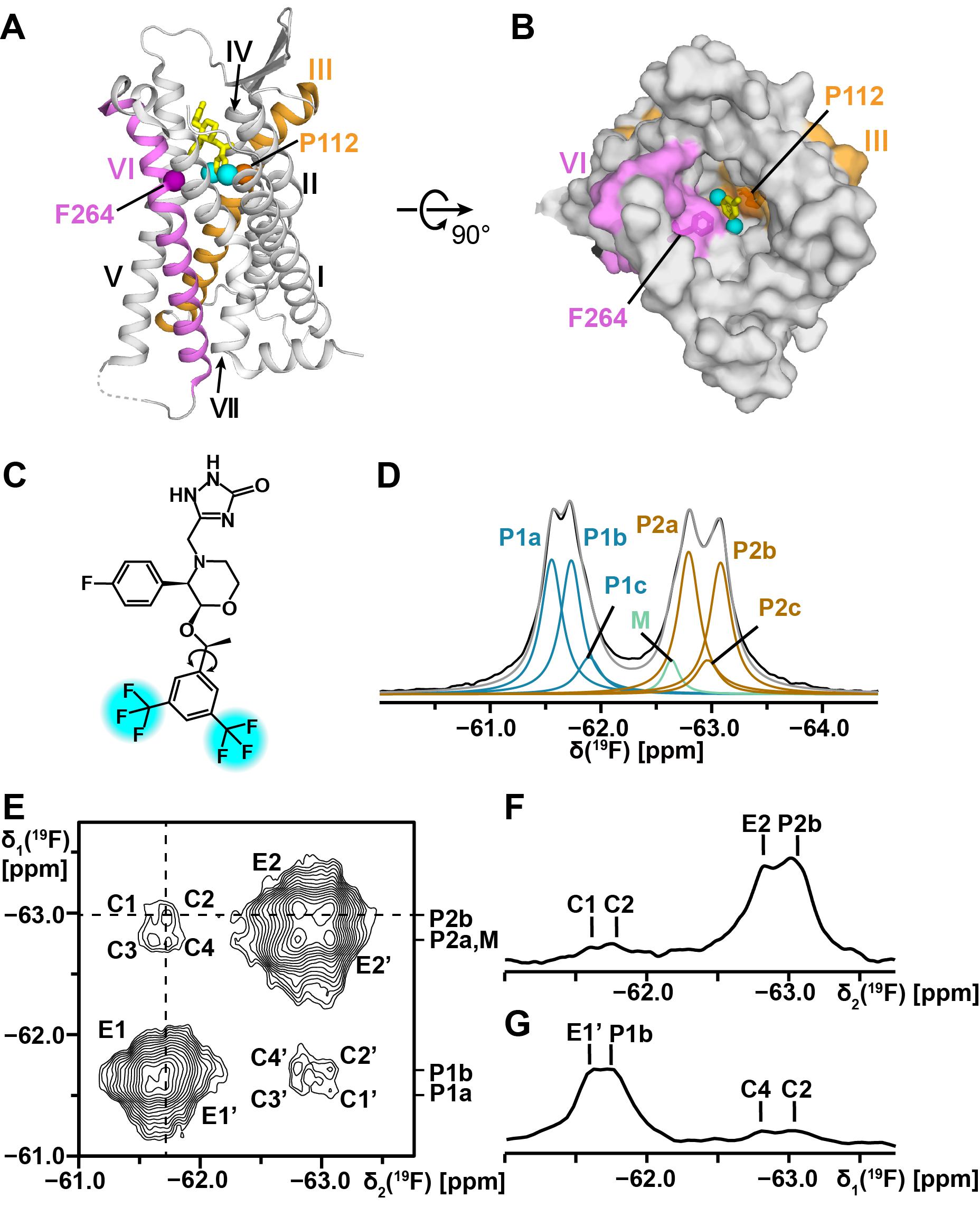
图1. 19F-NMR研究NK1R–aprepitant复合体
该研究进一步通过实验测量得到这一运动的速率在秒的尺度,在分子运动中是一种比较慢的过程。通过重组神经激肽1受体于纳米磷脂盘中,仍然观察到相似的苯环翻转现象,可以想象GPCR这种大尺度运动就如人的肺一样“呼吸”。另外推测GPCR的这种大尺度运动可能与配体的筛选过程相关。受体正构口袋的大尺度运动能够根据配体的大小结构等特征初步筛选进入的配体;已经进入结合口袋的配体在与受体结合口袋周围残基的相互作用中进一步筛选,释放出结合较弱的配体,最终得到受体与多种高亲和力效应配体结合的复合物。这一过程的阐释为GPCR功能的理解和相关的药物筛选提供了新思路(图2)。
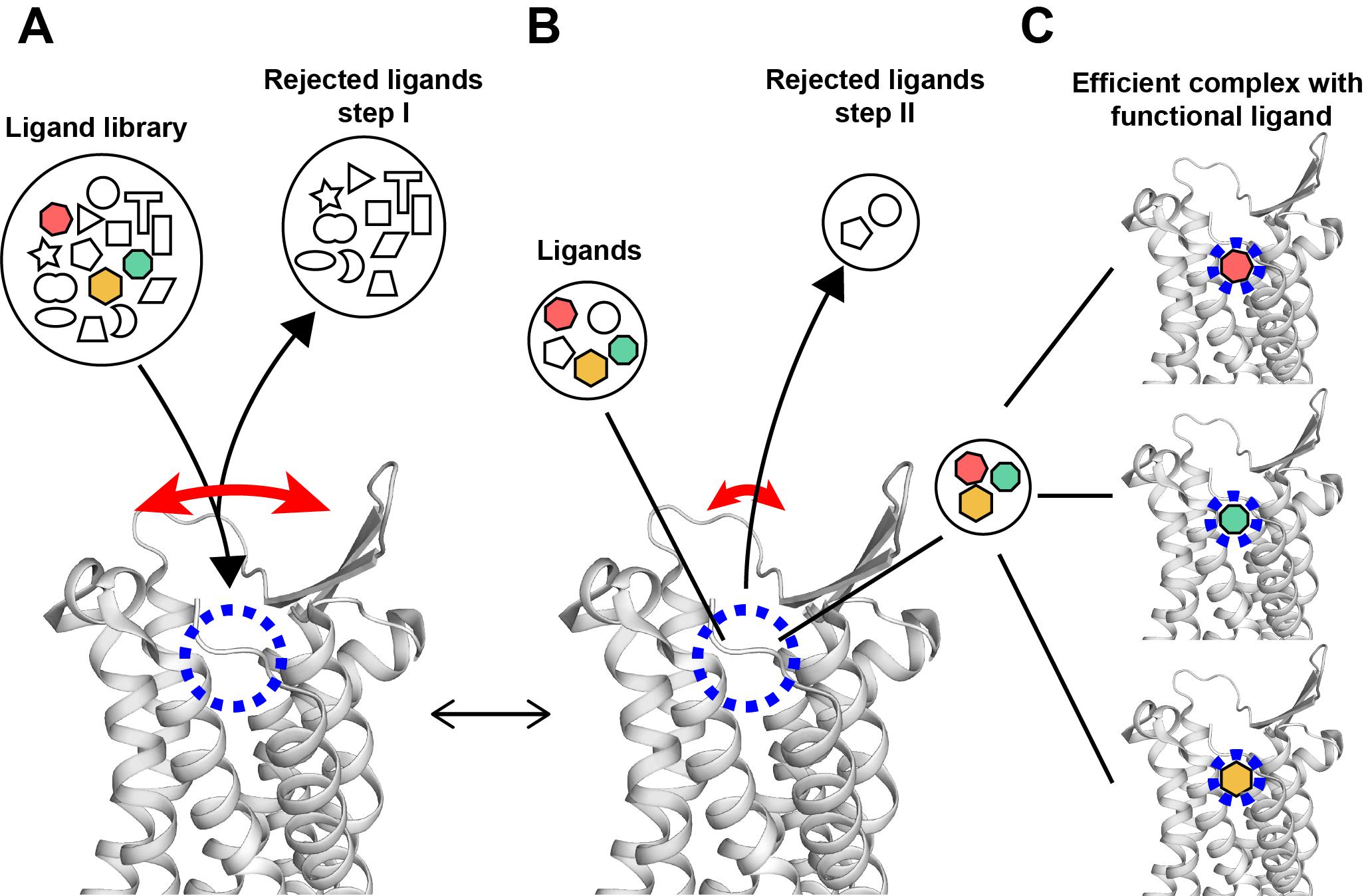
图2. GPCR对配体筛选过程的假想模型
上海科技大学生命学院2018级博士生潘本勋为该论文的第一作者,iHuman研究所特聘教授Kurt Wüthrich为本文通讯作者,副研究员刘东升和核磁平台杨凌云对于本工作亦有重要贡献。

论文标题:GPCR large-amplitude dynamics by 19F-NMR of aprepitant bound to the neurokinin 1 receptor
文章链接:https://www.pnas.org/doi/10.1073/pnas.2122682119


 沪公网安备 31011502006855号
沪公网安备 31011502006855号