2019年12月3日,我校iHuman研究所、生命学院助理教授赵素文和钟桂生课题组在Cell Reports上共同发文两篇,报道了两个α类受体的三个晶体结构,阐释了肾上腺素受体多样性和配体特异性的机理。两个α2受体的研究由钟桂生课题组、赵素文课题组、Raymond Stevens课题组、刘志杰课题组、陶厚朝课题组和高通量筛选平台合作完成。博士生曲露和研究助理教授周庆同、博士生陈小玉和高通量平台主管徐越溟分别为两篇文章的共同一作。钟桂生研究员、赵素文研究员和研究副教授武栋在两篇文章中均为共同通讯作者。论文的主要参与者还包括钟桂生、赵素文和陶厚朝三个课题组的多名工作人员和研究生。
人的肾上腺素受体是介导儿茶酚胺作用的G蛋白偶联受体,是重要的药物靶标。1948年,Raymond Ahlquist根据六种儿茶酚胺类药物在不同组织中作用效力的排序不同,做出了一个里程碑式的推断,即肾上腺素受体应有α和β两类。随着研究逐渐深入,直到1991年科学家才完全弄清楚肾上腺素受体有三类(α1, α2和β)九种亚型(α1A, α1B, α1D, α2A, α2B, α2C, β1, β2和β3)。2007年,β2肾上腺素受体的非激活态结构获得解析,这是第一个人源G蛋白偶联受体的晶体结构,是G蛋白偶联受体结构解析的重大突破。2011年,β2肾上腺素受体和G蛋白的复合物结构获得解析,该工作获得了2012年诺贝尔化学奖。这些结构的解析极大地推动了人们对G蛋白偶联受体(特别是β肾上腺素受体)机理的理解。然而,三类肾上腺素受体偶联的G蛋白不同:α1, α2和β类分别偶联Gq,Gi和Gs。通过序列比对,也可以发现三类受体的配体结合口袋也有明显区别。对肾上腺素受体下游信号选择的多样性以及配体的亚型选择性的理解,一直受制于缺乏α类受体的三维精细结构。
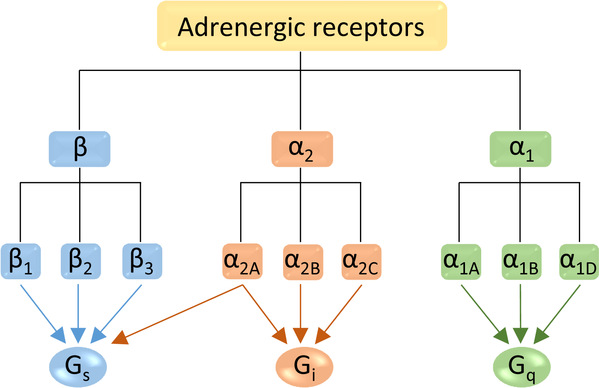
图1:肾上腺素受体各亚型及对应的G蛋白通路
在“Structural Basis of the Diversity of Adrenergic Receptors(肾上腺素受体多样性的结构基础)”一文中,作者通过解析α2A受体与部分激动剂和抑制剂的复合物结构、细胞信号实验和计算生物学,分析阐明了在肾上腺素受体家族中序列多样性是如何导致功能多样性的。
α2A受体的两个结构整体非常相似,而配体结合口袋的多个残基(包括在肾上腺素受体中不保守的F4127.39)则发生了剧烈的构象变化。通过观察结构和突变实验,研究人员解释了影响配体选择性的重要氨基酸F4127.39的功能:F4127.39是配体结构口袋的“盖子”,它与口袋中的另外三个芳香氨基酸一起形成了一个芳香笼来结合配体中的正电基团,使配体结合时空间和能量效应俱佳。突变F4127.39会使α2A受体的完全激动剂和部分激动剂均丧失效力。
α2A受体具有双重药理学效应:激动剂浓度较低时,α2A受体主要和Gi偶联;激动剂浓度较高时,与Gs的偶联占据更主导的地位。相应地,在临床中,α2A受体部分激动剂的效果比完全激动剂要好,如用于降压的可乐定(Clonidine)和用于ICU镇静(在我国也广泛用于手术麻醉)的右美托咪定(Dexmedetomidine)都是α2A受体的部分激动剂。为了更好地理解α2A受体的部分激活性(partialagonism),研究人员对多个已知的α2A受体完全激动剂和部分激动剂进行了分子对接,他们发现可以用配体与Y3946.55形成氢键与否,来区分α2A受体的部分激动剂和完全激动剂。作者还发现了三个氨基酸(Y3946.55,I13934.51和K14434.56,第一个位于配体结合口袋,后两个位于G蛋白结合口袋)对α2A受体的G蛋白选择性具有重要作用。精心设计的三个突变体Y3946.55N,I13934.51A和K14434.56A,在细胞信号实验中对部分激动剂的刺激均表现出Gi通路的偏好性,而Gs通路的活性遭到削弱甚至完全被抑制。
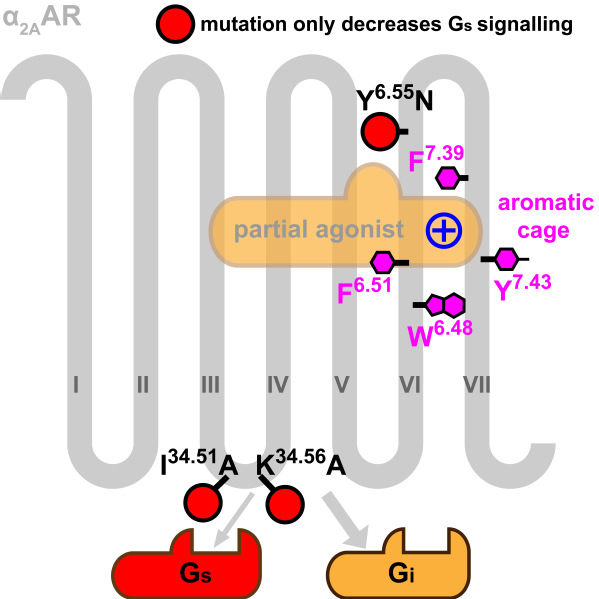
图2:α2A受体中对配体结合(紫色)和G蛋白通路偏好性(红色)起关键作用的残基
而在“Molecular mechanism for ligand recognition and subtype selectivity of α2C adrenergic receptor(α2C肾上腺素受体配体识别和亚型选择性的分子机制)”中,作者展示了α2C受体的三维结构,并通过分子对接、功能实验等手段揭示了α2亚型受体的结构特异性,为相关药物研发提供了分子基础。
以往的研究显示,α2肾上腺素受体主要分布在去甲肾上腺素能神经的突触前膜上,受体激动时可抑制儿茶酚胺的释放,担负着重要的负反馈调节作用。该家族的三种α2受体有着精细的分布和分工,α2C在这三个亚型中具有独特的性质,如在降温时从胞内向细胞膜迁移。之前的工作往往只提到三种受体跨膜区和口袋的高同源性而忽视了亚型选择性,导致亚型受体的研究停留在动物基因修饰(敲除或过表达)和体外细胞水平上。
通过将α2C受体与α2A受体的结构进行对比和巧妙的嵌合体设计,作者发现α2C与α2A的结构主要差异存在于胞外域。在α2C受体口袋边沿,D206ECL2-R409ECL3-Y4056.58形成氢键-盐桥互作网络,特异地影响了α2C受体选择性拮抗剂JP1302和OPC-28326的作用。而在α2A受体口袋上方,由Y98ECL1、R187ECL2、E189ECL2和R4057.32形成的互作网络直接遮盖了部分入口,使得JP1302和OPC-28326这些较大的分子可能被阻挡在外。细胞信号实验结果也显示,破坏Y98ECL1-R187ECL2-E189ECL2-R4057.32互作网络并添加D206ECL2-R409ECL3-Y4056.58相互作用得到的α2A嵌合体对JP1302和OPC-28326有着很好响应。

图3:α2CAR-RS79948复合物的结构和决定α2肾上腺素受体亚型选择性的胞外域
这两篇文章很好地阐述了肾上腺素受体的多样性和α2受体的配体选择性,为基于精细三维结构的下一代α2受体药物开发奠定了基础。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号