近日,中科院上海营养与健康研究院杨力研究员(我校特聘教授)与我校生命学院陈佳教授课题组开展合作研究,系统性揭示了一系列具有代表性的基因组碱基编辑器(base editor)的效能差异,并进一步构建了可利用20种已报道碱基编辑器进行编辑的人类疾病相关单碱基突变位点的数据库(BEable-GPS, Base Editable prediction of Global Pathogenic SNVs),相关成果以“Comparison of cytosine base editors and development of the BEable-GPSdatabase for targeting pathogenic SNVs” 为题,近日在国际知名学术期刊Genome Biology上在线发表。
由CRISPR/Cas基因编辑酶(如Cas9, Cpf1等)与胞嘧啶脱氨编辑酶(如APOBEC等)整合而成的胞嘧啶碱基编辑系统,可在单碱基水平实现高效率的靶向C-to-T编辑。理论上来讲,这种碱基编辑效果的实现不依赖于DNA双链切割活性,可避免对基因组造成损伤,因此具有较高的安全性,未来有望运用于人类疾病相关单碱基突变的定向矫正,在临床应用中拥有巨大潜力。自胞嘧啶碱基编辑器2016年被首次被报道以来,目前已有数十种改良版本被开发,它们分别由不同的基因编辑酶(如SpCas9, SaCas9, LbCpf1等)和不同的胞嘧啶脱氨酶(如rat APOBEC1, human APOBEC3A等)组成。但是,由于这些碱基编辑器作用位点的偏好性差异,目前尚未有研究对这些编辑器的效能进行系统性比较,同时,基因编辑领域中对不同碱基编辑器可作用的人类疾病相关单碱基突变位点也未见整合和总结。
在这项最新的合作研究中,科研人员首先对五种具有代表性的碱基编辑器(包括BE3,eBE-S3, BE4max,hA3A-eBE-Y130F和dCpf1-eBE)可共同编辑的单碱基位点进行了生物信息学分析,通过对这5种碱基编辑器在共同靶向位点的编辑效率和编辑产物纯度的系统研究,发现BE4max和hA3A-eBE-Y130F可实现最高的编辑效率;同时,由于hA3A-eBE-Y130F碱基编辑器整合了高催化活性的hA3A胞嘧啶脱氨酶,其在人类疾病相关突变位点的编辑能力最为突出。另一方面,由于dCpf1-eBE碱基编辑器整合了完全丧失DNA内切酶活性的dCpf1(dCas12a)基因编辑酶,其在碱基编辑过程中能产生最少的编辑副产物,因此具有最高的编辑产物纯度。为了更好地促进碱基编辑器在人类疾病相关突变位点的基础理论和潜在临床应用研究,科研人员收集整合了所有目前已知人类疾病相关突变位点的信息,并运用生物信息学算法预测了约20种碱基编辑器在这些突变位点的作用潜力(图1)。预测结果显示,利用这些碱基编辑器可模拟产生约94.34%的疾病相关C-to-T单碱基突变,同时可纠正约94.28%的疾病相关T-to-C单碱基突变,相关信息以BEable-GPS数据库的形式供研究人员查询使用(http://www.picb.ac.cn/rnomics/BEable-GPS)。同时,该数据库还整合了对任意序列进行碱基编辑预测的服务功能,为碱基编辑器的广泛应用研究提供了计算生物学理论支持。
陈佳教授长期从事DNA损伤修复机制以及基因编辑相关的研究工作,此前已阐明APOBEC胞嘧啶脱氨酶在CRISPR/Cas9介导的基因编辑过程中产生突变的分子机制(Lei et al., 2018, Nature Structural & Molecular Biology);在此基础上成功创建多种高效率、高精准型碱基编辑器(Wang et al., 2017, Cell Research;Li et al., 2018, Nature Biotechnology;Wang et al., 2018, Nature Biotechnology;Li et al., 2019, Cell Research);并应邀撰写综述评论等探讨基因编辑领域的未来发展方向(Chen et al., 2018,Cell;Chen et al., 2019, Nature Biotechnology;Yang et al., 2019, The CRISPR Journal)。
该论文中,中科院上海营养与健康研究院计算生物学研究所杨力研究组2015级硕博连读研究生王滢,与陈佳课题组2016级硕博连读研究生高润泽、研究助理吴晶为共同第一作者,陈佳、杨力为共同通讯作者。该项研究得到了科技部、国家自然科学基金委和上科大科研启动基金的支持。
文章链接:https://genomebiology.biomedcentral.com/articles/10.1186/s13059-019-1839-4
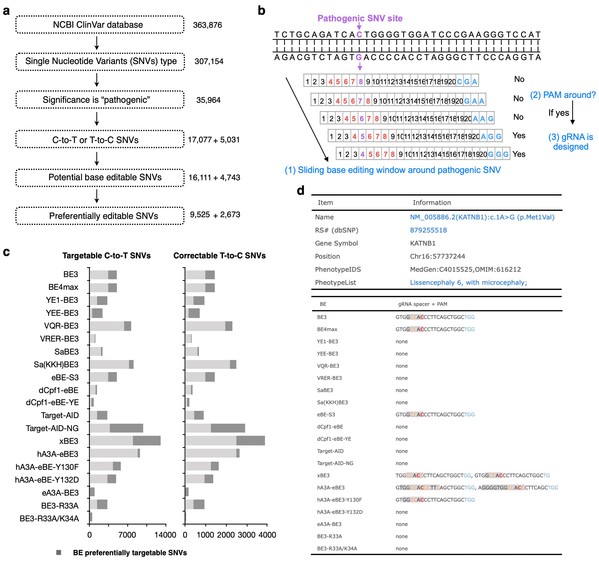
图1:计算生物学方法预测可编辑的致病突变位点及BEable-GPS数据库构建。(a)可编辑的人类疾病相关单碱基突变位点的筛选流程。(b)判断人类疾病相关单碱基突变位点能否被碱基编辑器编辑的流程示意图。(c)统计20种碱基编辑器可编辑的人类疾病相关单碱基突变位点的数目。(d)BEable-GPS分析显示一个可编辑的人类疾病相关单碱基突变位点信息及相应单碱基编辑器的gRNA设计结果。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号