近日,上海科技大学iHuman研究所徐菲课题组与上海交通大学医学院附属第九人民医院精准医学研究院雷鸣课题组合作在人体细胞信号转导研究领域获重大突破,成功解析了首个人源孤儿受体(GPR52)三维精细结构(如下图所示),揭示了孤儿受体在无配体、有配体以及与下游信号转导分子G蛋白复合物结合的各功能状态的结构特征,首次解密了有趣的GPCR自激活现象及其结构基础。北京时间2月20日凌晨,该成果以“Structural basis of ligand recognition and self-activation of orphan GPR52”为题,在国际顶尖学术期刊Nature上在线发表,同期的news and views对本文做了专门报道。值得一提的是,该研究是上海科技大学iHuman研究所今年初在国际顶尖杂志Cell上发表文章后又一项高水平、系统性的研究成果。这也是青年副教授、研究员徐菲课题组继2018年8月在Nature上发表首个卷曲受体三维精细结构之后的又一重大突破。
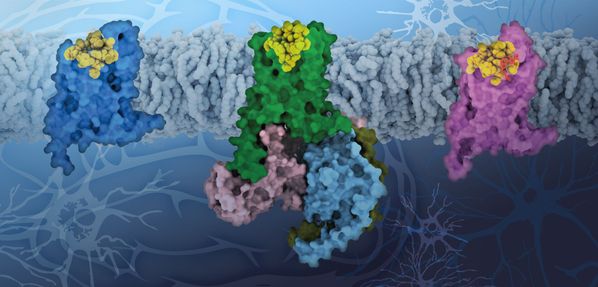


人体细胞表面分布着许多G蛋白偶联受体(GPCR),其功能相当于细胞的“信号兵”。这些“信号兵”负责细胞内和细胞间的信息交流,进而广泛参与人体生理或病理状态的调节。举个例子,当你困了的时候也许需要来一杯咖啡,咖啡中的咖啡因分子正是作用在一个叫“咖啡因受体”(一种腺苷受体,主要分布在大脑和其他组织中)的经典GPCR而发挥生理作用的。这里,咖啡因分子就是这个信号分子,也叫配体。再比如,临床上用到最多的用于镇痛的吗啡,就是主要作用于人体内细胞表面的阿片受体——GPCR中最古老的药物靶点之一。肩负如此重要的细胞信号传导作用又是广泛分布在细胞的表面,GPCR的功能一旦受损就可能引起各种人类疾病,如炎症、糖尿病、神经退行性疾病、癌症等。因此,GPCR长期以来一直是药物研发领域的“宠儿”,目前市场上超过30%的在售药物都以GPCR为靶点。
GPCR是具有7个跨膜螺旋结构域的膜蛋白,在人类基因组中有800多个成员,目前已有超过60个GPCR的精细结构被相继报道,有力推动了基于分子结构的合理药物设计与开发。“近年来GPCR的结构报道层出不穷,然而对孤儿受体结构的了解仍然是空白,”徐菲课题组的硕博连读研究生、论文的第一作者林浠说:“因此我选择了一个孤儿受体作为我的研究课题,希望能在这个难点领域有所突破”。孤儿受体(orphan receptor)因其内源性配体(即体内天然信号分子)尚未被发现而得名,目前已发现的有100多个,却没有一个已知的分子结构被报道。GPR52是一个典型的孤儿GPCR,主要在大脑中表达并发挥重要的生理作用,被认为是治疗各种精神疾病,包括亨廷顿病、精神分裂症、认知障碍、脑畸形和和多动症的潜在靶点。“在了解了GPR52这个孤儿受体的重要性之后,我坚信我的研究课题会对整个孤儿受体领域的认知有所推动。这更加坚定了我要攻克第一个孤儿受体结构的决心。”林浠说。
GPR52与非孤儿GPCR的序列相似性极低(小于20%),这阻碍了使用传统GPCR实验方法对其结构的深入理解和工具配体的发现。“为此,我们花了近四年时间反复筛选蛋白的基因构造和结晶条件。”徐菲副教授说,“最终我们在不破坏蛋白功能的前提下使蛋白自身处于一个稳定的适宜结晶的状态,从而通过晶体学的方法解析了无配体状态的受体结构。”在这个结构中,研究人员惊讶地发现了GPR52独特的第二个胞外环(ECL2)构象,几乎充满了整个GPCR配体结合口袋,似乎扮演了一个内置型配体的角色。上海交通大学医学院雷鸣课题组利用精准医学研究院的电镜平台,以冷冻电镜技术揭开了一个“自激活”状态的GPCR与其下游G蛋白复合物结构的神秘面纱。之所以称其“自激活”,是因为受体的活性状态不是由配体分子刺激实现的,而是完全依靠自身的特殊机制——即上述ECL2结构域形成的内置型激活态构象。“这在之前是无法想象的,”徐菲说,“因为此前报道的所有GPCR-G蛋白复合物都要求有一个关键性的激动剂配体起到稳定整个结构的作用”。至此,整个故事已经接近完整了,但是研究人员没有放弃追问:既然这个通常的配体口袋被受体自身的结构域占据了,那么真正的配体分子结合在哪里呢?这个问题显然也对寻找“脱孤”线索,即确定内源性配体的结合机制很重要。因此,研究人员紧接着尝试了GPR52与一个激活性工具配体分子c17的共结晶,并迅速解析了GPR52结合c17的复合物结构,该结构首次发现了一个“侧位口袋”(sidepocket)。c17配体所占据的这个侧位口袋,既不同于传统的GPCR正构位点,也未在之前报道的各类别构位点中出现过。这一特性可被发掘用来进行合理性药物设计,提高药物作用的选择性和特异性。
iHuman研究所执行所长刘志杰教授对该成果的获得感到十分欣喜:“研究所在过去4年中连续发表高影响力的研究成果,这充分得益于上科大和研究所高水平公共服务平台的鼎力支持。”
上海科技大学的副教授、研究员徐菲,上海交通大学的雷鸣和武健研究员为该论文共同通讯作者,徐菲课题组2015级硕博连读生林浠、2017级硕博连读生王年冬、雷鸣课题组2017级硕士研究生李明月及iHuman研究所赵素文课题组助理研究员吴屹然为论文共同第一作者,上科大为第一完成单位。该项研究同时获得了科技部、国家自然科学基金委、上海市科委及上海市政府的经费支持。
论文链接:https://www.nature.com/articles/s41586-020-2019-0



 沪公网安备 31011502006855号
沪公网安备 31011502006855号