我校免疫化学研究所的Katsuhiko Mikoshiba教授课题组建立了一种新颖简单的制备稳定细胞质抗体(STAND)的方法,这种抗体能够在细胞质中正确折叠并稳定表达。这种创新的方法不需要复杂的氨基酸替换,便可成功将易于聚集的抗体转化为各种在体内功能齐全的稳定细胞质抗体(STANDs)。
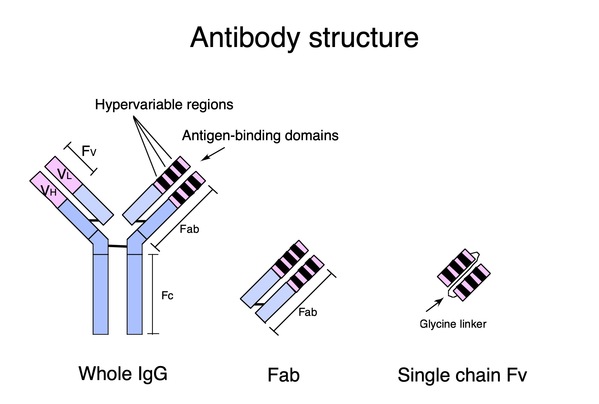
抗体是基础研究中的有力工具,由于它们与抗原特异性结合,并通过抑制蛋白-蛋白相互作用而干扰靶向分子通路,因此具有治疗疾病的潜能。虽然许多关键的药物靶标是细胞内分子,但大多数基于抗体的疗法仅限于细胞外靶标。单链Fv(scFv)是抗体基因中的最常见形式,其胞内表达存在错误折叠和聚集倾向,是一项久待解决的挑战。细胞质是一个还原性的环境,阻止scFv轻、重链Fvs内二硫键的形成,从而导致胞内聚集(图1)。目前尚无可靠的方法来设计哺乳细胞内稳定的胞质内包体。

图1:(a)scFvs在哺乳细胞内的细胞质聚集,箭头表示由EGFP标记的scFv胞内聚集。(b)STAND蛋白的稳定表达。
研究人员发现在pH6.6时聚集程度与净负电荷呈显著负相关,但在pH7.4时无显著负相关(图2a);我们还发现它们的pI值与聚集率之间存在统计学上显著的正相关(图2b)。这些结果表明,在pH6.6而非pH7.4时,scFv抗体的低pI和强净负电荷是细胞质抗体稳定性的关键参数。将肽段标签在pH6.6的环境下与强净负电荷融合可以将易于聚集的scFvs转化为STANDs。Synaptotagmin是神经递质释放的钙离子传感器,其STAND可以在多巴胺能神经元的细胞质中稳定表达(图3)和抑制纹状体多巴胺的释放,形成运动性能学习(图4)。他们还成功将易于聚集的抗Kras scFv转化为STAND,Kras被公认为“无药可救”的致癌蛋白,通过突变Kras可抑制体内癌症增殖(图5)。STAND方法有望在基础生物学领域中定位内源性胞质蛋白,并可在将来用于疾病治疗。
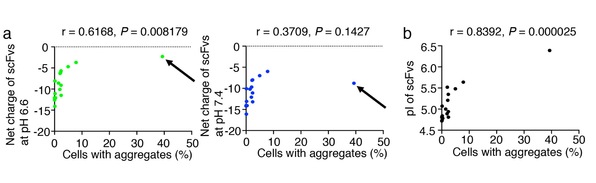
图2:(a)pH6.6而非pH7.4时,HeLa细胞中scFvs的净负电荷与聚集程度的统计相关性。eGFP标记的scFv-A36克隆(箭头所指)的净负电荷(图右)在pH6.6时显著下降(图左)。(b)HeLa细胞中scFvs的pI值与聚集度的统计学相关性。

图3:黑质致密部多巴胺能神经元中AAV介导的STAND稳定表达。STAND-A36:SynaptotagminI/II STAND蛋白稳定表达。没有STANDs,抗体在细胞中聚集。
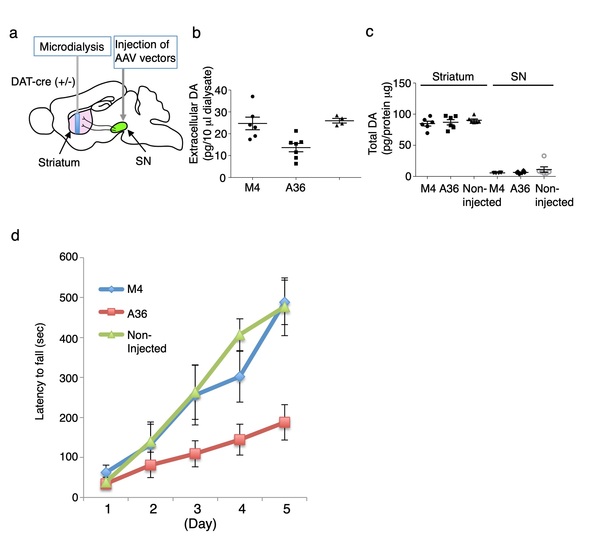
图4:Synaptotagmin STAND-A36抑制纹状体多巴胺的释放和运动技能的学习。(a)微透析收集的细胞外多巴胺(DA)。纹状体中的细胞外(b)和总(c)多巴胺。(d)转棒测试。STAND-M4:由STAND-A36衍生的突变体,缺乏与突触结合蛋白的结合活性。STAND-A36的胞内表达降低了体内纹状体的基础多巴胺释放。在小鼠右大脑半球纹状体SNc注射AAV的33天进行微透析。

图5:Kras的STAND-Y13-259 抑制肿瘤增殖。表达scFv蛋白的慢病毒载体每周进行瘤内注射。STAND-Y13-259:从易于聚集的scFv-Y13-259克隆中成功制备出的一种特异性结合Kras的STAND蛋白。
该研究成果以“An ultra-stable cytoplasmic antibody engineered for in vivo applications”为题发表在Nature Communications。工作的合作者包括Hiroyuki kabayama(日本兽医和生命科学大学),Shin-ichi Muramatsu教授(日本自治医科大学)和Mitsunori Fukuda教授(日本东北大学)。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号