我校生命学院陆珺霞课题组与中国科学院上海生物化学与细胞生物学研究所胡红雨课题组合作,近日在知名学术期刊Journal of the American Chemical Society(美国化学会志)上在线发表题为“Solid-state NMR reveals the structural transformation of the TDP-43 amyloidogenic region upon fibrillation”的研究论文。
TDP-43(TAR DNA binding protein-43)作为一种多功能的核酸结合蛋白,在细胞内广泛参与RNA的调控。课题组研究了带有融合蛋白的TDP-43(311-360)片段的纤维化过程,揭示液液相分离(liquid-liquid phase separation,LLPS)是TDP-43蛋白纤维化的中间步骤。该研究还利用固态核磁共振(Solid-state Nuclear Magnetic Resonance Spectroscopy ,SSNMR)等技术发现在蛋白聚集过程中的结构转变(图1),并识别出一系列稳定蛋白质纤维结构的关键位点。研究人员通过对这一纤维化过程的深入研究,了解诱导TDP-43蛋白纤维化的关键位点和相互作用,可以对今后的药物设计抑制蛋白纤维化和由此引发的神经退行性疾病提供潜在的靶标。
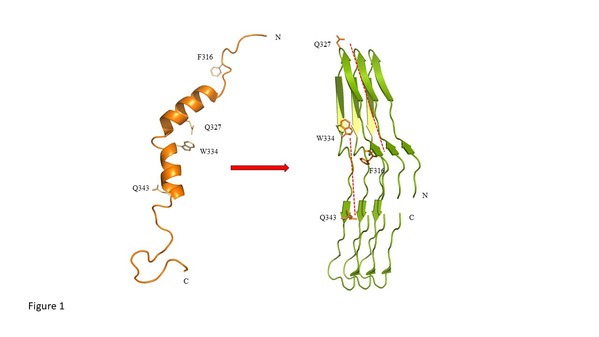
图1 蛋白聚集过程结构变化模拟图
TDP-43在患者细胞如神经元和神经胶质细胞内以淀粉样形式存在,是肌萎缩侧索硬化症和额颞叶变性运动神经元疾病的主要病理标志性蛋白之一。正常情况下,TDP-43在细胞应激环境下能参与形成应激颗粒,以应对细胞环境变化。应激颗粒是通过可逆的液液相分离聚集成的无膜结构,但是错误的聚集会导致不可逆的淀粉样蛋白沉淀。了解这些蛋白沉淀的形成过程和结构特征,将为神经退行性疾病的药物研发提供新思路。
此前的研究发现全长TDP-43或C末端具有液液相分离现象,在本研究通过微分干涉差显微镜(Differential Interference Contrast Microscope,DIC)和透射电子显微镜(Transmission Electron Microscope, TEM)发现带有融合蛋白的TDP-43(311-360)片段也能够经历液液相分离过程,并逐渐转变为纤维形态。在获得TDP-43(311-360)片段结构均一的蛋白纤维样品后,研究人员利用TEM和X-Ray多晶衍射发现纤维状的蛋白的确具有cross-β淀粉样纤维结构。同时,该研究重点利用魔角旋转(Magic Angle Spinning,MAS)固态核磁技术进一步发现在纤维二级结构中,每一个单体中具有5个β-strands,形成具有平行规则排列的cross-β构象。
一些神经退行性疾病如ALS,也称渐冻人症,常被认为是“比癌症还残忍的绝症”,但目前还没有有效的治疗药物,其药物的研发道路仍然困难重重。该工作聚焦于TDP-43蛋白结构,由结构带来启发,蛋白纤维化过程的揭示有助于了解致病原因;关键氨基酸的发现有助于药物靶点设计的研究。
本论文的第一作者为上科大生命学院2016级硕士研究生卓晓凤,陆珺霞教授和胡红雨教授为共同通讯作者,上科大为第一完成单位。该工作得到了科技部国家重点研发项目、国家自然科学基金、上海市扬帆计划的资助。本论文工作完全在上科大完成,上海科技大学生命学院分子成像平台、生物核磁平台、分子和细胞生物学平台、物质学院分析仪器中心和学校生物电镜平台提供了设备和支持。


 沪公网安备 31011502006855号
沪公网安备 31011502006855号