我校物质学院材料和物理生物学研究部钟超课题组在利用模块基因方法设计包含多个结构域淀粉样蛋白纤维材料以及在研究结构域如何影响蛋白的自组装和功能特性方面取得重要进展。最近,该项成果以“Modular Genetic Design of Multi-domain Functional Amyloids: Insights into Self-assembly and Functional Properties”为题,在《Chemical Science》上在线发表。
天然蛋白质分子通常由多个蛋白质结构域以模块化的方式组成,其中结构域的结构和功能,以及它们的排列影响着蛋白质的自组装。工程基于蛋白质的分子材料可以模仿甚至超越其天然的蛋白特性。通过合理设计蛋白质分子序列,使用模块化策略构建功能性淀粉样蛋白,为定制具有特定结构和功能的分子材料提供了可能,为工程新的多功能分子材料创造了机会。尽管这方面的研究目前已取得了一些进展,但融合的结构域模块是如何影响淀粉样蛋白的自组装和功能特性并不清楚,因此需要更深入地了解融合的结构域如何影响淀粉样蛋白的稳定性、形态、自组装动力学、机械性能以及功能等性质,这些研究对于推进未来以淀粉样蛋白为基的纳米技术或分子材料的应用非常重要。
该研究以大肠杆菌生物被膜中的Curli纤维为模型,系统地研究了融合基因模块对CsgA的组装动力学和功能的影响。实验设计主要以来自大肠杆菌生物被膜蛋白的淀粉样蛋白CsgA为核心,以一个或两个基因模块为侧翼融合功能域,包括来自环状芽孢杆菌几丁质酶的几丁质结合域(CBDs)和贻贝足蛋白(Mfps)。研究发现融合的功能域并没有破坏CsgA典型的β-sheet二级结构,但确实影响了所得到的融合蛋白纤维的自组装速率、形态和刚度:长度方面,融合蛋白越多会导致CsgA纤维长度越短;刚度方面,融合蛋白结构域中的二级结构β-sheet倾向于提高杨氏模量,而α-helix或者随机卷曲结构会降低杨氏模量。
此外,含有CBD结构域的CsgA纤维表现出更高的几丁质结合活性,但是融合蛋白CBD-CsgA-Mfp3的几丁质结合能力明显低于Mfp5-CsgA-CBD。研究人员推断这是由于其分子未能正确折叠导致的,结合分子动力学的建模最终证实了这一推断。该研究为模块基因策略构建多结构域的功能性淀粉样蛋白提供了新的理解,为未来设计基于淀粉样蛋白的功能分子材料奠定了基础。
该论文第一作者是我校物质学院2016级博士研究生崔孟奎,2013级硕士研究生锜琦(已毕业)、麻省理工学院博士后Thomas Gurry为共同第一作者,通讯作者是物质学院材料和物理生物研究部的钟超教授,上科大是第一完成单位。此外,中科院上海有机化学研究所生物交叉中心刘聪教授课题组,米兰理工大学的Francesco Briatico Vangosa教授以及麻省理工学院的Timothy K.Lu教授也参与了该项研究。上科大物质学院分析测试平台,中科院上海有机化学研究所生物交叉中心,国家蛋白质科学研究上海设施,以及中科院上海光源为材料表征给予了大力支持。该研究得到了国家自然科学联合基金项目、国家自然科学基金面上项目以及上科大科研启动基金的支持。
文章链接:https://pubs.rsc.org/en/content/articlelanding/2019/sc/c9sc00208a#!divAbstract
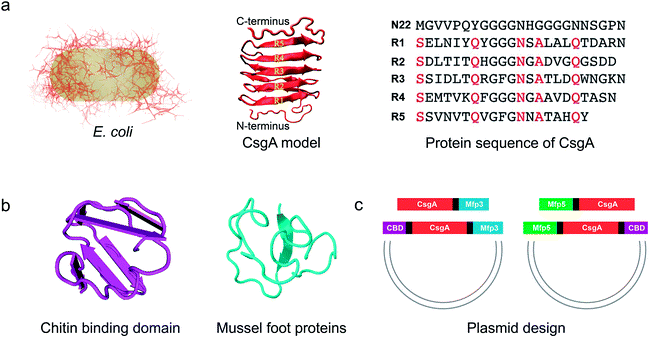
基因模块化构建基于CsgA的功能性淀粉样蛋白
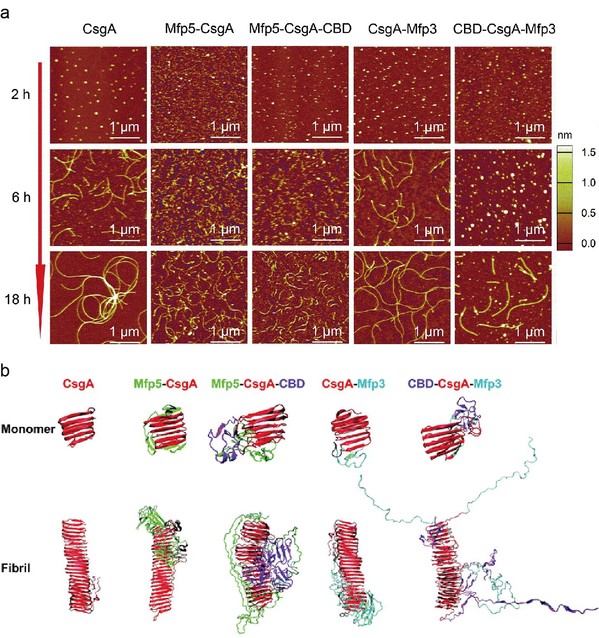
(a)原子力显微镜表征CsgA及其融合蛋白的动态自组装过程中纤维形貌变化(b)分子动力学模拟CsgA及其融合蛋白的动态自组装


 沪公网安备 31011502006855号
沪公网安备 31011502006855号